lítio
| propriedades | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Geralmente | |||||||||||||||||||
| Nome , símbolo , número atômico | Lítio, Li, 3 | ||||||||||||||||||
| Categoria de elemento | Metais alcalinos | ||||||||||||||||||
| Grupo , período , bloco | 1 , 2 , s | ||||||||||||||||||
| Aparência | branco prateado / cinza | ||||||||||||||||||
| Número CAS | |||||||||||||||||||
| Número CE | 231-102-5 | ||||||||||||||||||
| ECHA InfoCard | 100.028.274 | ||||||||||||||||||
| Fração da massa do envelope da terra | 60 ppm 27. Frequência | ||||||||||||||||||
| Atômico | |||||||||||||||||||
| Massa atômica | 6,94 (6,938-6,997) e semelhantes | ||||||||||||||||||
| Raio atômico (calculado) | 145 (167) pm | ||||||||||||||||||
| Raio covalente | 128 pm | ||||||||||||||||||
| Raio de Van der Waals | 182 pm | ||||||||||||||||||
| Configuração de elétron | [ Ele ] 2 s 1 | ||||||||||||||||||
| 1. Energia de ionização | 5.391 714 95 (4) eV ≈ 520.22 kJ / mol | ||||||||||||||||||
| 2. Energia de ionização | 75.640 096 4 (13) eV ≈ 7 298.16 kJ / mol | ||||||||||||||||||
| 3. Energia de ionização | 122.454 358 1 (8) eV ≈ 11 815.05 kJ / mol | ||||||||||||||||||
| Fisicamente | |||||||||||||||||||
| Estado físico | fixo | ||||||||||||||||||
| Modificações | 1 | ||||||||||||||||||
| Estrutura de cristal | cúbico centrado no corpo | ||||||||||||||||||
| densidade | 0,534 g / cm 3 (20 ° C ) | ||||||||||||||||||
| Dureza de Mohs | 0,6 | ||||||||||||||||||
| magnetismo | paramagnético ( Χ m = 1,4 10 −5 ) | ||||||||||||||||||
| Ponto de fusão | 453,69 K (180,54 ° C) | ||||||||||||||||||
| ponto de ebulição | 1603 K (1330 ° C) | ||||||||||||||||||
| Volume molar | 13,02 · 10 −6 m 3 · mol −1 | ||||||||||||||||||
| Calor da vaporização | 136 kJ / mol | ||||||||||||||||||
| Calor de fusão | 3 kJ mol −1 | ||||||||||||||||||
| Velocidade do som | 6000 m s -1 a 293,15 K. | ||||||||||||||||||
| Capacidade de calor específica | 3482 J kg −1 K −1 | ||||||||||||||||||
| Função no trabalho | 2,9 eV | ||||||||||||||||||
| Condutividade elétrica | 10,6 · 10 6 A · V −1 · m −1 | ||||||||||||||||||
| Condutividade térmica | 85 W m −1 K −1 | ||||||||||||||||||
| Quimicamente | |||||||||||||||||||
| Estados de oxidação | +1 | ||||||||||||||||||
| Potencial normal | -3,04 V | ||||||||||||||||||
| Eletro-negatividade | 0,98 ( escala de Pauling ) | ||||||||||||||||||
| Isótopos | |||||||||||||||||||
| |||||||||||||||||||
| Para outros isótopos, veja a lista de isótopos | |||||||||||||||||||
| Propriedades de NMR | |||||||||||||||||||
| |||||||||||||||||||
| instruções de segurança | |||||||||||||||||||
| |||||||||||||||||||
|
Tanto quanto possível e usual, unidades SI são usadas. Salvo indicação em contrário, os dados fornecidos aplicam-se às condições padrão . | |||||||||||||||||||
Lítio (derivado do grego antigo λίθος líthos , alemão 'pedra' ; pronúncia [ ˈliːti̯ʊm ] ou também [ ˈliːʦi̯ʊm ]) é um elemento químico com o símbolo Li e o número atômico 3. É um elemento do primeiro grupo IUPAC , o grupo dos metais alcalinos , e pertence ao segundo período da tabela periódica dos elementos. O lítio é um metal leve e tem a densidade mais baixa de elementos sólidos em condições padrão .
O lítio não ocorre elementarmente na natureza devido à sua alta reatividade. Em temperatura ambiente, ele só é estável por muito tempo em ar completamente seco, mas reage lentamente para formar nitreto de lítio (Li 3 N). No ar úmido, uma camada cinza fosca de hidróxido de lítio se forma rapidamente na superfície . Como todos os metais alcalinos, reage lítio elementar em contacto com a humidade da pele e, portanto, conduz a graves queimaduras químicas e queimaduras . Em contraste com os compostos de sódio e potássio correspondentes , muitos compostos de lítio que formam íons de lítio em solução aquosa são rotulados como prejudiciais.
Como oligoelemento , o lítio na forma de seus sais é um componente comum da água mineral . Pequenas quantidades de lítio estão presentes no organismo humano ; no entanto, o elemento não é essencial e não tem função biológica conhecida. No entanto, alguns sais de lítio têm um efeito medicinal e são usados na terapia de lítio para transtornos do efeito bipolar , mania , depressão e cefaleias em salvas (ver medicamento ).
história

O descobridor do lítio sueco aplica a Johan August Arfwedson que em 1817 a presença de um elemento estranho na petalita (Li [4] Al [4] [Si 4 O 10 ]) e logo depois no espodumênio (LiAl [Si 2 O 6 ]) e lepidolita (K (Li, Al) 3 [(Al, Si) 4 O 10 ] (F, OH) 2 ) quando ele analisou achados minerais da ilha de Utö, na Suécia . Seu professor acadêmico Jöns Jakob Berzelius sugeriu litião , uma derivação do grego λίθος líthos 'pedra', como um nome que, de acordo com os nomes dos outros dois metais alcalinos sódio e potássio conhecidos na época, indica o material do qual era extraído. A forma latinizada de lítio prevaleceu.
Em 1818, o químico alemão Christian Gottlob Gmelin notou que os sais de lítio dão uma cor vermelha de chama . Ambos os cientistas falharam nas tentativas de isolar esse elemento nos anos que se seguiram. Em 1818, William Thomas Brande e Sir Humphry Davy tiveram sucesso pela primeira vez usando um processo eletrolítico de óxido de lítio (Li 2 O). Em 1855, Robert Bunsen e Augustus Matthiessen produziram grandes quantidades de lítio puro eletrolisando o cloreto de lítio (LiCl). Em 1917, Wilhelm Schlenk sintetizou os primeiros compostos de organolítio a partir de compostos orgânicos de mercúrio .
Com a primeira produção comercial em 1923, os alemães começaram a Metallgesellschaft na Hans-Heinrich Hut em Langelsheim em resina por derretimento de lítio e eletrólise de cloreto de potássio (KCl) .
Até pouco depois da Segunda Guerra Mundial, o lítio praticamente não existia, exceto como lubrificante (óleo mineral, engrossado com estearato de lítio ) e na indústria do vidro ( carbonato de lítio ou óxido de lítio ). Isso mudou quando os Estados Unidos precisaram do trítio , feito de lítio, para fazer bombas de hidrogênio . Uma ampla produção começou, especialmente em Kings Mountain, Carolina do Norte . Devido às grandes quantidades de lítio necessárias devido à curta meia-vida do trítio , um grande suprimento de lítio foi acumulado entre 1953 e 1963, que só foi colocado no mercado em 1993, após o fim da Guerra Fria . Além da mineração, a extração mais barata da salmoura agora também se tornou importante. Grandes quantidades de lítio são agora utilizadas para baterias , para a polimerização de elastômeros , na indústria da construção e para a síntese orgânica de produtos farmacêuticos e agroquímicos. Desde 2007, as baterias primárias e acumuladores ( baterias secundárias ) têm sido o segmento mais importante.
Ocorrência e mineração
Ocorrência na terra
O lítio tem uma participação de cerca de 0,006% da crosta terrestre . Ocorre um pouco menos freqüentemente do que o zinco e mais freqüentemente do que o cobalto , o estanho e o chumbo na crosta terrestre. Embora o lítio seja mais abundante que o chumbo, por exemplo, sua maior distribuição dificulta sua obtenção. O lítio é encontrado na água potável e em alguns alimentos, como carne, peixe, ovos e laticínios. 100 g de carne contêm cerca de 100 μg de lítio. Várias plantas, como o tabaco ou o botão -de- ouro, retiram compostos de lítio do solo e os enriquecem. A proporção média da matéria seca das plantas está entre 0,5 ppm e 3 ppm. A água do mar contém em média 180 µg / L e a água do rio em torno de 3 µg / L.
Esgotamento e reservas
Em termos de volume, 35.000 toneladas de lítio foram extraídas fora dos EUA em 2015 e comercializadas principalmente como carbonato de lítio (Li 2 CO 3 ). Em 2016, o Chile foi o maior produtor. A Austrália triplicou sua produção entre 2016 e 2017 e aumentou novamente em quase 50% até 2018. Atualmente (2018) quase dois terços das reservas de lítio na Austrália são extraídos da mineração de rochas duras e apenas cerca de um terço da salmoura. As reservas nas minas existentes são estimadas em cerca de 17 milhões de toneladas (em janeiro de 2020). Os depósitos mundiais de salmouras continentais, salmouras geotérmicas, minerais de hectorita, salmouras de campos de petróleo e pegmatita de rocha ígnea foram estimados em 80 milhões de toneladas.
Os maiores recursos estão na Bolívia (21 milhões de toneladas), Argentina (17 milhões de toneladas), Chile (9 milhões de toneladas), EUA (6,8 milhões de toneladas), Austrália (6,3 milhões de toneladas) e China (4,5 milhões de toneladas). Na Europa, a Alemanha (2,5 milhões de toneladas) e a República Tcheca (1,3 milhão de toneladas) possuem os maiores depósitos.
| Produção mundial [toneladas] | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 (estimado) | Reservas de mina | Depósitos mundiais |
|---|---|---|---|---|---|---|---|---|
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 9.000.000 | 21.000.000 |
|
|
11.500 | 10.500 | 14.300 | 14.200 | 17.000 | 18.000 | 8.600.000 | 9.000.000 |
|
|
2.300 | 2.000 | 2.300 | 6.800 | 7.100 | 7.500 | 1.000.000 | 4.500.000 |
|
|
13.300 | 14.100 | 14.000 | 40.000 | 58.800 | 42.000 | 2.800.000 | 6.300.000 |
|
|
3.200 | 3.600 | 5.800 | 5.700 | 6.400 | 6.400 | 1.700.000 | 17.000.000 |
|
|
300 | 200 | 400 | 800 | 800 | 1.200 | 60.000 | 250.000 |
|
|
160 | 200 | 200 | 200 | 300 | 300 | 95.000 | 400.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 630.000 | 6.800.000 |
|
|
900 | 900 | 1.000 | 800 | 1.600 | 1.600 | 230.000 | 540.000 |
|
|
n. v. | n. v. | n. v. | n. v. | 2.400 | 200 | 370.000 | 1.700.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 3.000.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.000.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.000.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1.700.000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 50.000 |
| mundo | 31.700 | 31.500 | 38.000 | 69.000 | 95.000 | 77.000 | 17.000.000 | 80.000.000 |
Depósitos primários
O lítio ocorre em alguns minerais nos pegmatitos de lítio . Os minerais mais importantes são ambligonita (LiAl [PO 4 ] F), lepidolita (K (Li, Al) 3 [(Al, Si) 4 O 10 ] (F, OH) 2 ), petalita (mamona; LiAl [Si 4 O 10 ]) e espodumênio (trifano; LiAl [Si 2 O 6 ]). Esses minerais têm um conteúdo de lítio de até 9% (para amblgonita). Outros minérios de lítio mais raros são a criolita ionita (Li 3 Na 3 [AlF 6 ] 2 ), que tem o maior conteúdo de lítio de todos os minerais, trifilina (Li (Fe II , Mn II ) [PO 4 ]) e zinnwaldita (K ( Li, Fe, Al) 3 [(Al, Si) 4 S 10 ] (F, OH) 2 ). Lítio Minerais vêm em muitos silicato - rochas antes, mas normalmente só em baixas concentrações. Não existem grandes depósitos. Uma vez que a extração de lítio desses minerais é associada a um grande esforço, eles desempenham um papel secundário atualmente na extração de lítio ou de seus compostos, mas isso pode mudar devido à alta demanda esperada. Os principais locais de mineração são as minas Greenbushes e Mt. Cattlin na Austrália Ocidental , em cujas rochas pegmatíticas há uma alta concentração de lítio e nas quais o lítio é um subproduto da extração de tântalo . Também em alguns outros países como Canadá e Rússia , até 1998 também na cidade de Bassemer , Carolina do Norte , espodumênio é extraído para a produção de lítio.
A Europa possui campos pegmatíticos ricos em Li no Weinebene da Caríntia, no distrito de Wolfsberg , na região finlandesa de Ostrobothnia , nas montanhas do minério e entre a Espanha ( Almendra ) e Portugal ( distrito da Guarda , Boticas ).
Enquanto a primeira produção comercial de compostos de lítio per se começou nas montanhas Harz já em 1923, a produção nos depósitos importantes recentemente desenvolvidos na Áustria e na Finlândia poderia começar em 2021. Eles são operados pela Global Strategic Metals ou Keliber . Na Áustria, no Koralpe em Lavanttal , os túneis de teste mostraram uma ocorrência muito maior de rocha contendo lítio, estimada em 22 milhões de toneladas. Isso o torna um dos primeiros projetos de mineração de lítio em grande escala na Europa e pode ser operado por 20 anos. A ocorrência perto de Zinnwald nas montanhas de minério está sendo explorada pela Deutsche Lithium .
Depósitos secundários
Os sais de lítio, especialmente o cloreto de lítio , também são amplamente encontrados na salmoura, principalmente em lagos de sal . A concentração pode ser de até um por cento. Além da concentração de lítio, a proporção de magnésio para lítio é importante para a qualidade da salmoura. Atualmente, o lítio é usado principalmente no Chile ( Salar de Atacama , que tem 0,16% com a maior concentração de lítio conhecida), Argentina ( Salar de Hombre Muerto ), Estados Unidos da América ( Silver Peak , Nevada) e República Popular da China ( Chabyêr Caka , Tibete; Lago Taijinaier , Qinghai). O lago salgado boliviano Salar de Uyuni, com uma estimativa de 5,4 milhões de toneladas de lítio, é possivelmente o maior recurso. A estatal Yacimientos de Litio Bolivianos investe com parceiros alemães e chineses em sua industrialização, incluindo os vizinhos Salar de Coipasa e Laguna Pastos Grandes , desde 2018 . Existem outros lagos de sal contendo lítio que (em abril de 2019) ainda não são usados para mineração industrial, por exemplo, na China, Argentina e Afeganistão . Em 2016, soube-se que na Bacia do Paradoxo, no estado de Utah , nos Estados Unidos, foram encontradas águas profundas de alto teor salino ( salmoura ) em poços de exploração de petróleo já na década de 1960 , dos quais, de acordo com análises da época, até 1700 mg / L de lítio puro pode ser obtido.
Carbonato de potássio (cloreto de potássio), bórax , césio e rubídio são frequentemente obtidos como subprodutos produtos em produção de lítio .
Devido à forte demanda esperada de lítio para baterias em veículos elétricos, em 2010 algumas empresas examinaram a extração de minerais contendo lítio e salmoura em várias regiões do mundo, incluindo a Europa. A extração de lítio da água do mar também está sendo pesquisada. Aproximadamente 230 bilhões de toneladas de lítio são dissolvidas nos oceanos do mundo. Em 2018, os pesquisadores apresentaram um método de extração em que o lítio pode ser obtido da água do mar usando eletrólise movida a energia solar . Eles citaram uma vantagem sobre a extração convencional de que o lítio metálico é obtido diretamente no processo e, portanto, o processamento posterior (complexo e intensivo em energia) pode ser dispensado, como é necessário na extração tradicional de lítio de minérios.
No Instituto Leibniz para Novos Materiais , o projeto de pesquisa MERLIN de dois anos ( extração de lítio em água de mineração ) começou em novembro de 2020 , com o qual a extração de lítio da água de mina será testada.
Ocorrência fora da terra
Após o Big Bang , além dos isótopos de hidrogênio e hélio, uma quantidade significativa do isótopo 7 Li foi formada. A maior parte disso não está mais disponível hoje, porque nas estrelas o lítio foi fundido com o hidrogênio no processo da reação próton-próton II e, portanto, foi consumido. Nas anãs marrons , entretanto, a massa e a temperatura não são altas o suficiente para a fusão do hidrogênio; sua massa não atinge o tamanho necessário de cerca de 75 massas de Júpiter . O lítio produzido durante o Big Bang, portanto, só foi preservado em grandes quantidades nas anãs marrons. Por esta razão, o lítio também é um elemento relativamente raro extraterrestre , mas pode ser usado para detectar anãs marrons.
A distribuição do lítio nas diferentes estrelas é muito diferente, mesmo que a idade, a massa e a metalicidade sejam semelhantes. Acredita-se que os planetas tenham um impacto no conteúdo de lítio de uma estrela. Se uma estrela não tem planetas, o conteúdo de lítio é alto, enquanto estrelas como o Sol, que estão rodeadas por planetas, têm apenas um baixo teor de lítio, também conhecido como mergulho de lítio . Acredita-se que a causa seja que as forças de maré dos planetas contribuem para uma mistura mais forte das camadas externa e interna das estrelas, de modo que mais lítio entra em uma área que é quente o suficiente para fundi-lo.
Processo de produção
O lítio é obtido principalmente da água salgada (lençóis freáticos, lagos salgados) por meio da evaporação. A extração de rochas na mineração a céu aberto é rara .
De água salgada
Para extrair o lítio, a água salgada subterrânea é bombeada para a superfície e passada por uma cadeia de lagoas de evaporação, nas quais a evaporação ao sol ocorre durante vários meses. Uma vez que o cloreto de lítio atingiu a concentração necessária nos tanques, a solução é bombeada para uma planta de processamento, onde o boro ou magnésio indesejados são extraídos e filtrados. Em seguida, é tratado com carbonato de sódio . O carbonato de lítio precipitado é filtrado e seco. O excesso de salmoura residual é bombeado de volta para o lago de sal. Em regiões áridas como o Chile, o uso da água subterrânea promove o ressecamento da paisagem.
representação
O carbonato de lítio é precipitado de soluções de sal contendo lítio por evaporação da água e adição de carbonato de sódio (soda) . Para fazer isso, a salmoura é primeiro concentrada no ar até que a concentração de lítio exceda 0,5%. O carbonato de lítio moderadamente solúvel é precipitado pela adição de carbonato de sódio:
- .
Para obter lítio metálico, o carbonato de lítio é primeiro reagido com ácido clorídrico . Isso cria dióxido de carbono , que escapa como um gás, e cloreto de lítio dissolvido . Esta solução é concentrada em um evaporador a vácuo até que o cloreto se cristalize:
Os aparelhos e sistemas de extração de cloreto de lítio devem ser feitos de aços especiais ou ligas de níquel , pois a salmoura é muito corrosiva . O lítio metálico é eletrólise de sal fundido de uma mistura eutética de fusão a 450-500 ° C de 52 por cento em massa de cloreto de lítio e 48 por cento em peso de cloreto de potássio foi preparado:
O potássio não é depositado durante a eletrólise porque tem um potencial de eletrodo menor no fundido de cloreto . No entanto, traços de sódio também são depositados e tornam o lítio particularmente reativo (vantajoso em química orgânica, ruim para baterias de lítio). O lítio líquido se acumula na superfície do eletrólito e pode, portanto, ser descarregado da célula de eletrólise com relativa facilidade. Também é possível obter lítio eletrolisando cloreto de lítio em piridina . Este método é particularmente adequado em escala de laboratório.
Importância econômica e comércio de matéria-prima
Uma vez extraído, o lítio chega às indústrias de processamento como matéria-prima via comércio . No comércio de commodities , especialmente nos mercados de metais , não se comercializa lítio puro, que seria quimicamente instável. Em vez disso, os compostos de lítio estáveis são comercializados, i. d. Normalmente com sais de lítio ou pilhas de cristal à base de lítio , predominantemente carbonato de lítio ou monohidrato de hidróxido de lítio . Essas substâncias são i.a. negociados na London Metal Exchange . Em 2020, foi registrado um preço de US $ 8,75 / kg para o carbonato de lítio (teor mínimo de 99,5%) e um preço de US $ 10,25 / kg para o hidróxido de lítio monohidratado (teor mínimo 56,5%).
Além de cotar o lítio como matéria-prima, existem desde 2010 fundos de índices de lítio (ETFs) que podem ser negociados em bolsa. Esses ETFs mapeiam o valor de mercado das empresas que estão envolvidas na cadeia de valor do lítio. Desde 2010 existe um índice de desempenho das ações da Solactive , que acompanha a capitalização de mercado das maiores empresas listadas envolvidas na exploração e mineração de lítio e na produção de baterias de lítio. Os dez maiores valores neste índice são (em ordem decrescente de tamanho, em abril de 2020): Albemarle , SQM , Tesla , BYD , Samsung , Simplo Technology , LG Chem , Panasonic , GS Yuasa e Enersys . Os poucos ETFs de lítio geralmente rastreiam esse índice.
propriedades
Propriedades físicas
O lítio é um metal leve e branco prateado . É o mais leve de todos os elementos sólidos à temperatura ambiente ( densidade 0,534 g / cm³). Apenas o hidrogênio sólido a -260 ° C é ainda mais leve, com uma densidade de 0,0763 g / cm³.
Como os outros metais alcalinos, o lítio cristaliza em um empacotamento de esfera cúbica centrada no corpo no grupo espacial Im 3 m (grupo espacial no. 229) com o parâmetro de rede a = 351 pm e duas unidades de fórmula por célula unitária . Em baixas temperaturas de 78 K, a estrutura cristalina muda por transformação espontânea em uma estrutura hexagonal do tipo magnésio com os parâmetros de rede a = 311 pm ec = 509 pm ou após a deformação em uma estrutura cúbica do tipo cobre (face cúbica - centrado) com o parâmetro de rede a = 438 pm em. As causas exatas da estrutura formada são desconhecidas.
Dos metais alcalinos, o lítio tem o ponto de fusão e ebulição mais alto , bem como a maior capacidade de calor específico . O lítio tem a maior dureza de todos os metais alcalinos, mas com uma dureza de Mohs de 0,6 ele ainda pode ser cortado com uma faca. Como um metal típico, é um bom condutor de eletricidade (condutividade: cerca de 18% do cobre) e calor.
O lítio é muito semelhante ao magnésio , o que também se reflete no aparecimento de cristais heterotípicos mistos de lítio e magnésio, o chamado isodimorfismo . Embora o magnésio se cristalize no empacotamento hexagonal mais próximo, enquanto o lítio cristaliza no empacotamento cúbico centrado no corpo, os dois metais são amplamente heterotipicamente miscíveis. No entanto, isso só ocorre em uma faixa de concentração limitada, com o componente presente em excesso "forçando" sua rede cristalina sobre os demais.
O íon de lítio tem a maior entalpia de hidratação de todos os íons de metal alcalino a −520 kJ / mol . Como resultado, é totalmente hidratado em água e atrai fortemente as moléculas de água. O lítio forma dois hidratos, um interno com quatro moléculas de água, que estão fortemente ligados por meio de seus átomos de oxigênio ao íon de lítio, e uma camada externa, no hidrogênio acima liga mais moléculas de água com o Li [H 2 O] 4 + íon, respectivamente. Como resultado, o raio iônico do íon hidratado é muito grande, ainda maior do que o dos metais alcalinos pesados rubídio e césio , que não possuem tais camadas de hidratação fortemente ligadas em solução aquosa.
Como um gás , o lítio ocorre não apenas em átomos individuais, mas também na forma molecular como Dilithium Li 2 . O lítio de ligação simples, portanto, atinge um orbital atômico completo e, portanto, uma situação energeticamente favorável. O dilítio tem um comprimento de ligação de 267,3 pm e uma energia de ligação de 101 kJ / mol. No estado gasoso, cerca de 1% (em massa) do lítio está presente como dilítio.
Propriedades quimicas
Como todos os metais alcalinos, o lítio é muito reativo e reage prontamente com um grande número de elementos e compostos (como a água ), liberando calor . No entanto, é o menos reativo dos metais alcalinos. Uma característica especial que distingue o lítio de outros metais alcalinos é sua reação com o nitrogênio molecular para formar nitreto de lítio , que ocorre lentamente, mesmo em temperatura ambiente:
- .
Isso é possível devido à alta densidade de carga do íon Li + e, portanto, pela alta energia de rede do nitreto de lítio. Com -3,04 V, o lítio tem o potencial normal mais baixo na tabela periódica e é, portanto, o menos nobre de todos os elementos.
Como todos os metais alcalinos, o lítio é armazenado sob o petróleo ou o óleo de parafina , caso contrário, ele reagirá com o oxigênio e o nitrogênio contidos no ar.
Uma vez que os raios iônicos dos íons Li + e Mg 2+ são comparativamente grandes, há também semelhanças nas propriedades de lítio ou compostos de lítio e compostos de magnésio ou magnésio. Essa semelhança nas propriedades de dois elementos de grupos vizinhos na tabela periódica é conhecida como relação oblíqua na tabela periódica . Em contraste com o sódio, o lítio forma muitos compostos organometálicos ( compostos organolítio ), como butil - lítio ou metil-lítio . Relações semelhantes existem entre berílio e alumínio e entre boro e silício .
Isótopos
Os dois isótopos estáveis 6 Li (7,6%) e 7 Li (92,4%) ocorrem na natureza . Além disso, os isótopos instáveis são conhecidos, começando em 4 Li, 8 Li e 12 Li, que só podem ser produzidos artificialmente. Suas meias-vidas estão na faixa de milissegundos .
6 Li desempenha um papel importante na tecnologia de fusão nuclear. Ele serve tanto no reator de fusão nuclear quanto na bomba de hidrogênio como matéria-prima para a produção de trítio , que é necessário para a fusão de produção de energia com o deutério . O trítio é criado na manta do reator de fusão ou na bomba de hidrogênio ao lado do hélio bombardeando 6 Li com nêutrons, que surgem durante a fusão, após a reação nuclear
- .
A reação que também é possível
é menos adequado (ver manta ) . A separação pode ocorrer, por exemplo, por meio de uma troca isotópica de amálgama de lítio e um composto de lítio dissolvido (como cloreto de lítio em etanol) (denominado processo COLEX ). Rendimentos de cerca de 50% são alcançados.
Se em uma bomba de três estágios houver também 7 Li além de 6 Li (como foi o caso, por exemplo, com Castle Bravo ), esta reage com alguns dos nêutrons rápidos gerados durante a fusão. Isso cria nêutrons novamente, bem como hélio e trítio adicional. Embora a reação de nêutrons 7 Li consuma energia inicialmente, o resultado final é uma maior liberação de energia por meio de fusões adicionais e mais fissão nuclear na carcaça da bomba de urânio . O poder explosivo é, portanto, maior do que se apenas a parte de 6 Li da mistura de isótopos tivesse sido convertida na bomba. Uma vez que foi assumido antes do teste Castle Bravo que o 7 Li não reagiria com os nêutrons, a bomba era cerca de 2,5 vezes mais poderosa do que o esperado.
O isótopo de lítio 7 Li é produzido em pequenas quantidades em usinas nucleares por meio de uma reação nuclear do borisótopo 10 B (usado como absorvedor de nêutrons) com nêutrons.
Os isótopos 6 Li, 7 Li são usados em experimentos com gases quânticos frios . Foi assim que foi criado o primeiro condensado de Bose-Einstein com o isótopo ( bóson ) 7 Li. 6 O Li, por outro lado, é um férmion e, em 2003, foi possível transformar moléculas desse isótopo em um superfluido .
usar
A aplicação mais importante e de crescimento mais rápido para o lítio hoje é seu uso em acumuladores de íons de lítio (também chamados de baterias recarregáveis ). B. em smartphones , laptops , ferramentas de bateria ou veículos movidos a eletricidade , como carros híbridos , carros elétricos ou e-bikes (veja o diagrama à direita). A maioria dos sais de lítio produzidos não são reduzidos a metal, mas usados diretamente como carbonato de lítio, hidróxido de lítio, cloreto de lítio, brometo de lítio ou convertidos em outros compostos. O metal só é necessário em algumas aplicações. Os usos mais importantes dos compostos de lítio podem ser encontrados na seção " Conexões ".
metal
Parte do metal de lítio produzido é usado para a extração de compostos de lítio que não podem ser feitos diretamente do carbonato de lítio. Estes são compostos principalmente de lítio orgânico, como butil -lítio, compostos de lítio-hidrogênio, como hidreto de lítio (LiH) ou hidreto de alumínio e lítio e amida de lítio .
O lítio é usado para remover o nitrogênio dos gases devido à sua capacidade de reagir diretamente com o nitrogênio .
O lítio metálico é um agente redutor muito poderoso ; reduz muitas substâncias que não reagem com outros agentes redutores. É utilizado na hidrogenação parcial de aromáticos ( redução de Birch ). Na metalurgia , é utilizado para a dessulfurização , desoxidação e descarburação de fundidos de metal.
Como o lítio tem um potencial normal muito baixo , ele pode ser usado como ânodo em baterias . Essas baterias de lítio têm alta densidade de energia e podem gerar uma voltagem particularmente alta . As baterias de lítio não recarregáveis não devem ser confundidas com os acumuladores de íons de lítio recarregáveis, nos quais óxidos de metal de lítio, como óxido de lítio e cobalto, são conectados como cátodo e grafite ou outros compostos que armazenam íons de lítio como ânodo.
Fusão nuclear
O trítio necessário para a operação de reatores de fusão nuclear deve ser produzido na manta do reator de lítio-6.
Componente de liga
O lítio é ligado a alguns metais para melhorar suas propriedades. Muitas vezes, pequenas quantidades de lítio são suficientes para isso. Como um aditivo, melhora a resistência à tração , dureza e elasticidade em muitos materiais . Um exemplo de liga de lítio é o metal ferroviário , uma liga de chumbo com aproximadamente 0,04% de lítio usada como material de apoio em ferrovias. As propriedades mecânicas das ligas de magnésio-lítio e ligas de alumínio-lítio também são melhoradas com a adição de lítio. Ao mesmo tempo, as ligas de lítio são muito leves e, portanto, muito utilizadas na tecnologia aérea e espacial .
Pesquisa (física atômica)
Na física atômica , o lítio é frequentemente usado porque com 6 Li é o único metal alcalino com um isótopo fermiônico estável , razão pela qual é adequado para pesquisar os efeitos em gases quânticos fermiônicos ultrafrios (ver teoria BCS ). Ao mesmo tempo, tem uma ressonância de Feshbach muito ampla , o que permite ajustar o comprimento de espalhamento entre os átomos conforme desejado, pelo que os campos magnéticos não precisam ser mantidos particularmente precisos devido à largura da ressonância .
Medicina
O lítio foi usado pela primeira vez na medicina ocidental como remédio para a gota já em 1850 . No entanto, acabou sendo ineficaz. Outras abordagens para o uso médico de sais de lítio, inclusive como remédio para doenças infecciosas, também não tiveram sucesso.
Foi somente em 1949 que o psiquiatra australiano John Cade (1912–1980) descreveu um possível campo de aplicação para os sais de lítio. Ele injetou cobaias com vários compostos químicos, incluindo sais de lítio, após o que elas reagiram menos fortemente a estímulos externos e ficaram mais calmas, mas não sonolentas. Em retrospecto, descobriu-se que o efeito observado nos animais de teste foi devido à intoxicação. Depois de um autoexperimento do Cade, o uso de carbonato de lítio como medicamento para o tratamento de pacientes maníaco-depressivos foi investigado em um estudo duplo-cego no Hospital Psiquiátrico de Risskov (Dinamarca) de 1952 a 1954 . Isso lançou as bases para a terapia com lítio .
Nesse caso, o lítio na forma de sais, como o carbonato de lítio , é usado contra transtornos do afeto bipolar , mania , depressão e cefaléia em salvas . Deve-se observar que o intervalo terapêutico baixo está entre 0,6 mmol / L e 1,1 mmol / L e a provisão de espelho é necessária durante a terapia. Mesmo quando o nível de lítio no sangue está no limite superior da faixa terapêutica, efeitos colaterais controláveis e reversíveis podem ocorrer em pessoas sensíveis. No entanto, se o nível de lítio no sangue estiver bem acima da faixa terapêutica - ou seja, acima de 1,1 mmol / L - o risco de efeitos colaterais significativos a graves, como tremor , rigidez , náusea, vômito, arritmias cardíacas e leucocitose aumenta rapidamente. Acima de 3,0 mmol / L há perigo de vida. A razão é que o metabolismo do lítio e do sódio é semelhante. Níveis excessivos de lítio podem resultar de sudorese ou remédios para enxágue de sódio ( diuréticos natriuréticos ) com níveis decrescentes de sódio. O corpo tenta compensar a perda de sódio retirando o sódio da urina primária nos rins e transportando-o de volta para o sangue ( retenção de sódio ). Além do sódio, o lítio também é retido, que normalmente é excretado uniformemente pelos rins. O resultado é um nível de lítio aumentado, o que requer monitoramento do medicamento ao tomar lítio , no qual o nível de lítio é determinado regularmente e a dose é ajustada de acordo. Mesmo com a dosagem correta, o tratamento de longo prazo com lítio pode levar a perdas de água e sódio ( diabetes insipidus ), excesso de acidificação do sangue ( acidose ) e nefropatia de lítio com função renal prejudicada .
Um estudo publicado nos Estados Unidos em 1990 descreve uma redução significativa no crime e suicídio em regiões com elevadas concentrações de lítio na água potável .
O modo de ação do lítio como droga psicotrópica ainda não foi pesquisado de forma adequada. Em particular, a influência do metabolismo do inositol pela inibição do mio-inositol-1 fosfatase ( classe de enzima 3.1.3.25) e a inibição da glicogênio sintase quinase-3 (GSK-3) em células nervosas estão sendo atualmente discutidos como possíveis mecanismos. O efeito antidepressivo do lítio provavelmente também se baseia em um aumento na neurotransmissão serotonérgica, ou seja, uma liberação aumentada de serotonina nas sinapses , enquanto o efeito antimaníaco é explicado por uma inibição de receptores dopaminérgicos . Outro efeito interessante dos sais de lítio em humanos e mamíferos, como ratos, é a mudança provavelmente relacionada no ritmo circadiano . Esse efeito foi demonstrado até em plantas como a Kalanchoe . Outras substâncias serotonérgicas, como LSD , mescalina e psilocibina, também apresentam tais efeitos em humanos. Usando o lítio, experimentos em animais com moscas da fruta ( Drosophila melanogaster ) conseguiram combater os sintomas da doença de Alzheimer - como o esquecimento.
O pesquisador de idades Michael Ristow mostrou em 2011 uma possível conexão entre o conteúdo de lítio no meio ambiente e a expectativa de vida dos humanos: em um estudo populacional japonês, houve uma conexão estatisticamente significativa entre um maior teor de oligoelemento e uma maior expectativa de vida ; Além disso, as altas concentrações de lítio aumentaram a expectativa de vida do nematóide e do organismo modelo Caenorhabditis elegans .
prova
Os compostos de lítio mostram uma cor de chama vermelho carmim , as linhas espectrais características são as linhas principais em 670,776 e 670,791 nm; linhas menores estão em 610,3 nm. Além disso, o lítio pode ser detectado com a ajuda da fotometria de chama .
Uma detecção quantitativa com métodos químicos úmidos é difícil, uma vez que a maioria dos sais de lítio são facilmente solúveis. Uma possibilidade é por meio da precipitação do fosfato de lítio moderadamente solúvel . Para tanto, a amostra a ser examinada é alcalinizada com solução de hidróxido de sódio, por exemplo , e adiciona-se um pouco de hidrogenofosfato dissódico Na 2 HPO 4 . Quando aquecido, um precipitado branco se forma na presença de Li + :
Outra opção é usar o reagente de periodato de ferro .
Avisos de perigo
O lítio elementar na forma de pó de metal inflama no ar mesmo em temperatura normal. Por esse motivo, o lítio metálico também deve ser armazenado sob a exclusão de ar, geralmente no petróleo . Em temperaturas mais altas acima de 190 ° C, predominantemente o óxido de lítio é formado imediatamente em contato com o ar. Em oxigênio puro , o lítio inflama a partir de cerca de 100 ° C. Em uma atmosfera de nitrogênio puro , o lítio apenas reage mais rápido ao nitreto de lítio em temperaturas mais altas. O lítio pode reagir de forma explosiva ao entrar em contato com substâncias que contêm oxigênio ou halogênio.
Como o lítio reage fortemente exotermicamente com agentes extintores de incêndio comuns, como água , dióxido de carbono , nitrogênio ou o agora proibido tetracloreto de carbono , dispara com gases inertes, como. B. argônio ou outros agentes de combate a incêndio de metal, como sal (z. B. NaCl), podem ser extintos.
O lítio elementar, como todos os metais alcalinos , causa danos por queimaduras ou queimaduras químicas alcalinas em contato com a pele, pois forma hidróxido de lítio com água com forte emissão de calor; a umidade da pele é suficiente para isso.
links
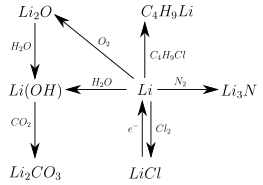
O lítio é muito reativo e forma compostos com a maioria dos não-metais, nos quais está sempre no estado de oxidação + I. Via de regra, possuem estrutura iônica , mas, ao contrário de compostos de outros metais alcalinos, apresentam alto teor covalente . Isso pode ser visto, entre outras coisas, no fato de que muitos sais de lítio - em contraste com os sais de sódio ou potássio correspondentes - são prontamente solúveis em solventes orgânicos, como acetona ou etanol . Também existem compostos orgânicos covalentes de lítio. Muitos compostos de lítio são semelhantes em suas propriedades aos compostos de magnésio correspondentes devido aos raios iônicos semelhantes ( relação oblíqua na tabela periódica ). O gráfico a seguir fornece uma visão geral das reações mais importantes do lítio. A estequiometria e as condições de reação precisas não são levadas em consideração aqui:
Compostos de hidrogênio
O hidrogênio forma hidretos com o lítio . O mais simples composto de lítio-hidrogênio, hidreto de lítio LiH, surge dos elementos a 600–700 ° C. É usado como combustível de foguete e para a produção rápida de hidrogênio, por exemplo, para inflar coletes salva- vidas . Existem também hidretos mais complexos, como borohidreto de lítio LiBH 4 ou hidreto de alumínio e lítio LiAlH 4 . Este último é de grande importância na química orgânica como um doador seletivo de hidrogênio, por exemplo, para a redução de compostos carbonila e nitro .
Deutereto de lítio (LiD) e triteto de lítio (LiT) desempenham um papel importante na pesquisa de fusão nuclear . Como o deutereto de lítio puro reduz a energia da bomba de hidrogênio, uma mistura de LiD e LiT é usada para isso. Essas substâncias sólidas são mais fáceis de manusear do que o trítio, com sua rápida taxa de efusão .
Compostos de oxigênio
Com o oxigênio, o lítio forma óxido de lítio Li 2 O e peróxido de lítio Li 2 O 2 .
Quando o lítio reage com a água, forma -se hidróxido de lítio , uma base forte. O hidróxido de lítio é usado para fazer graxas de lítio que são usadas como graxas lubrificantes para automóveis. Como o hidróxido de lítio também se liga ao dióxido de carbono, ele é usado para regenerar o ar em submarinos.
Mais compostos de lítio
O lítio forma sais da forma LiX com os haletos. Estes são fluoreto de lítio , cloreto de lítio , brometo de lítio e iodeto de lítio . Por ser muito higroscópico, o cloreto de lítio também é utilizado como dessecante, além de ser utilizado como matéria-prima para a produção de lítio. É utilizado para secar gases, como por exemplo o gás natural , antes de passar pelo gasoduto ou, em sistemas de ar condicionado, para reduzir a umidade (até 2% de umidade relativa). O cloreto de lítio também é usado para reduzir as temperaturas de fusão, em banhos de soldagem e brasagem e como revestimento de eletrodo de soldagem para soldagem de alumínio. O fluoreto de lítio é usado como cristal único na espectroscopia de infravermelho .
O composto de lítio tecnicamente mais importante é o carbonato de lítio moderadamente solúvel . É usado para extrair a maioria dos outros compostos de lítio e é usado como fundente na indústria do vidro e na fabricação de esmalte . Também é usado na produção de alumínio para melhorar a condutividade e a viscosidade do fundido.
Os sabonetes de lítio são sais de lítio de ácidos graxos . Eles são usados principalmente como espessantes em graxas e ceras lubrificantes à base de óleo mineral de alta qualidade e para a produção de lápis .
Outros sais de lítio são:
- Perclorato de lítio LiClO 4 ,
- Sulfato de lítio Li 2 SO 4 ,
- Nitrato de lítio LiNO 3 , é usado com nitrato de potássio na indústria da borracha para vulcanização ,
- Nitreto de lítio Li 3 N, é formado quando o lítio reage com nitrogênio,
- O niobato de lítio LiNbO 3 é transparente em uma ampla gama de comprimentos de onda e é usado em óptica e para lasers ,
- A amida de lítio LiNH 2 é uma base forte e é formada quando o lítio reage com a amônia líquida .
- O estearato de lítio C 18 H 35 LiO 2 , é um importante aditivo para óleos a fim de utilizá-los como graxas lubrificantes. Eles são usados em automóveis, moinhos de rolos e máquinas agrícolas. Os estearatos de lítio são muito fracamente solúveis em água, então a película lubrificante é retida quando eles entram em contato com pouca água. As graxas lubrificantes obtidas têm excelente estabilidade de temperatura (> 150 ° C) e permanecem lubrificantes até −20 ° C.
- Lítio de etilo C 2 H 3 LiO 2
- Citrato de lítio C 6 H 5 Li 3 O 7
- O hexafluorofosfato de lítio LiPF 6 é usado como um sal condutor em baterias de íon de lítio.
- O fosfato de lítio Li 3 PO 4 é usado como um catalisador para a isomerização do óxido de propileno.
- Metaborato de lítio LiBO 2 e tetraborato de lítio Li 2 B 4 O 7
- O brometo de lítio LiBr é um reagente para a produção de produtos farmacêuticos, mas também é utilizado em sistemas de refrigeração por absorção .
Compostos orgânicos de lítio
Em contraste com a maioria dos outros organilos de metal alcalino, os organilos de lítio desempenham um papel considerável, especialmente na química orgânica. De particular importância são o n- butil-lítio , o terc- butil-lítio , o metil - lítio e o fenil - lítio , que também estão comercialmente disponíveis na forma de suas soluções em pentano, hexano, ciclohexano ou, se apropriado, éter dietílico. Você pode por reação direta de lítio metálico com halogenetos de alquil / aril de acordo com
ou por transmetalação, por exemplo, a partir de organil mercúrio de acordo com
produzir.
Com lítio elementar em tetrahidrofurano (THF) em vez de magnésio em éter dietílico, reações de adição análogas de Grignard de halogenetos de alquila a compostos de carbonila podem geralmente ser realizadas com melhor rendimento.
Devido ao seu caráter claramente covalente, a estrutura do organil lítio raramente pode ser descrita por uma ligação Li-C simples. Existem principalmente estruturas complexas construídas a partir de unidades diméricas, tetraméricas ou hexaméricas ou estruturas poliméricas. Os organilos de lítio são compostos altamente reativos, alguns dos quais se inflamam espontaneamente no ar. Eles reagem explosivamente com água. Devido à sua extrema basicidade, eles também reagem com solventes cujo hidrogênio ligado dificilmente é ácido, como o THF , o que limita severamente a escolha de solventes adequados. As reações com eles só são possíveis com gás de proteção e em solventes secos. Portanto, é necessária alguma experiência em lidar com eles e é aconselhável muita cautela.
Outro grupo de derivados orgânicos de lítio são as amidas de lítio do tipo LiNR 2 , das quais diisopropilamida de lítio (LDA) e bis (trimetilsilil) amida de lítio ( LiHMDS , ver também HMDS ) são usadas como bases fortes sem atividade nucleofílica.
Os organilos de lítio são usados de muitas maneiras, por exemplo como iniciadores para a polimerização aniônica de olefinas, como agentes de metalação , desprotonação ou alquilação .
Os chamados cupratos de Gilman do tipo R 2 CuLi são de certa importância .
literatura
- AF Holleman , E. Wiberg , N. Wiberg : Textbook of Inorganic Chemistry . 102ª edição. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , pp. 1259-1270.
- NN Greenwood, A. Earnshaw: Chemistry of the Elements. 1ª edição. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9 , pp. 83-129.
- M. Binnewies: General and Inorganic Chemistry. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0208-5 , pp. 334-336.
- Ernst Henglein: Tecnologia de Metais Extraordinários. 1991, ISBN 3-8085-5081-3 .
- Harry H. Binder: Léxico dos elementos químicos - a tabela periódica em fatos, números e dados. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- Richard Bauer: Lítio - já que não está no livro didático. In: Chemistry in Our Time . 19, No. 5, 1985, pp. 167-173, doi: 10.1002 / ciuz.19850190505 .
- NJ Birch: Inorganic Pharmacology of Lithium. In: Chem. Rev. 99, No. 9, 1999, pp. 2659-2682, PMID 11749496 .
- Jürgen Deberitz, Gernot Boche: Lítio e seus compostos - importância industrial, médica e científica. In: Chemistry in Our Time . 37, No. 4, 2003, pp. 258-266, doi: 10.1002 / ciuz.200300264 .
- Michael Bauer, Paul Grof, Bruno Muller-Oerlinghausen (eds.): Lithium in Neuropsychiatry: The Comprehensive Guide. 1ª edição. Informa Healthcare, 2006, ISBN 1-84184-515-9 .
Links da web
- Resumo de metais alcalinos por wiley-vch (PDF; 2,2 MB)
- Baterias para carros eletrônicos: cinco fatos sobre lítio e cobalto (ZDF)
Evidência individual
- ↑ a b c Harry H. Binder: Léxico dos elementos químicos . S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Os valores das propriedades (caixa de informações) são retirados de www.webelements.com (lítio) , salvo indicação em contrário .
- ↑ O valor padrão recomendado pela IUPAC é dado, uma vez que a composição isotópica deste elemento pode variar localmente, a faixa de massa dada entre parênteses resulta para o peso atômico médio. Ver: Michael E. Wieser, Tyler B. Coplen: Pesos atômicos dos elementos 2009 (Relatório Técnico IUPAC). In: Pure and Applied Chemistry . 2010, p. 1, doi: 10.1351 / PAC-REP-10-09-14 .
- ^ IUPAC, pesos atômicos padrão revisados em 2013 .
- ↑ a b c Entry on lithium in Kramida, A., Ralchenko, Yu., Reader, J. e NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Ed.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Recuperado em 11 de junho de 2020.
- ↑ a b c Entrada sobre lítio em WebElements, https://www.webelements.com , acessado em 11 de junho de 2020.
- ^ NN Greenwood, A. Earnshaw: Química dos elementos. 1ª edição. VCH, Weinheim 1988, ISBN 3-527-26169-9 , página 97.
- ↑ Robert C. Weast (Ed.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , pp. E-129 a E-145. Os valores são baseados em g / mol e dados em unidades cgs. O valor especificado aqui é o valor SI calculado a partir dele, sem uma unidade de medida.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Valores corrigidos para pontos de ebulição e entalpias de vaporização de elementos em manuais. In: Journal of Chemical & Engineering Data . 56, 2011, pp. 328-337, doi: 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Textbook of Experimental Physics . Volume 6: sólidos. 2ª Edição. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , página 361.
- ↑ a b c d e f M. Hesse, H. Meier, B. Zeeh: métodos espectroscópicos em química orgânica . Thieme, 2002.
- ↑ a b c d Entrada sobre lítio no banco de dados de substâncias GESTIS do IFA , acessado em 30 de abril de 2017. (JavaScript necessário)
- ↑ Entrada de lítio no Inventário de Classificação e Rotulagem da Agência Europeia dos Produtos Químicos (ECHA), acessado em 1 de agosto de 2016. Os fabricantes ou distribuidores podem expandir a classificação e rotulagem harmonizadas .
- ↑ Wolfgang Pfeiler: quanta, átomos, núcleos, partículas. Walter de Gruyter GmbH & Co KG, 2017, ISBN 978-3-11-044571-8 , página 238.
- ↑ Max Mangold: O dicionário de pronúncia (= The Duden em 12 volumes. Volume 6). 6ª edição. 2005, ISBN 3-411-04066-1 , página 514.
- ^ Helmut de Boor , Hugo Moser, Christian Winkler (eds.): Siebs: Pronúncia alemão. Pronunciamento puro e moderado com dicionário de pronúncia . De Gruyter, Berlin 1969, p. 334 ( visualização limitada na pesquisa de livros do Google).
- ↑ Duden online oferece ambas as variantes de pronúncia, consulte lítio (com amostras de áudio do banco de dados de pronúncia ARD).
- ↑ N. Figurowski: A descoberta dos elementos químicos e a origem de seus nomes . Aulis-Verlag Deubner, Cologne 1981, ISBN 3-7614-0561-8 , página 135.
- ^ Christoph Elschenbroich : Organometallchemie. 5ª edição. Teubner , Leipzig 2005, p. 16.
- ↑ a b Jessica Elzea Kogel: Minerais e rochas industriais: commodities, mercados e usos. 7ª edição. SME, 2006, ISBN 0-87335-233-5 , p. 599 ( Minerais e rochas industriais na pesquisa de livros do Google).
- ↑ Pesquisa Geológica dos Estados Unidos : Anuário de Minerais 2007: Lítio . (PDF; 75 kB), 2007.
- ↑ a b c Hans Breuer : dtv-Atlas Chemie. Volume 1, 9ª edição. Deutscher Taschenbuch Verlag (dtv), Munique 2000, ISBN 3-423-03217-0 .
- ↑ a b Lítio - um criador de tensão no curso circulatório. ( Memento de 17 de julho de 2011 no Internet Archive ) In: VDI nachrichten . 7 de janeiro de 2011, p. 3.
- ↑ Onmeda Nutrient Lexicon , em 10 de junho de 2009.
- ↑ Peter Dolega, Matthias Buchert, Johannes Betz: Desafios ecológicos e socioeconômicos nas cadeias de abastecimento de baterias: grafite e lítio . Breve estudo criado como parte do projeto conjunto Fab4Lib da BMBF - pesquisa sobre medidas para aumentar a eficiência de materiais e processos na produção de células de bateria de íon-lítio ao longo de toda a cadeia de valor (FKZ 03XP0142E). Ed .: Oeko-Institut. Freiburg, Darmstadt, 29 de julho de 2020.
- ↑ a b c d e f USGS [United States Geological Survey] (2020): Mineral Commodity Summaries 2020 - Lithium Data Sheet. URL: https://pubs.usgs.gov/periodicals/mcs2020/mcs2020-lithium.pdf (PDF; 130 kB) (acesso = 2020-09-07)
- ↑ Meridian International Research: The trouble with Lithium 2. (PDF; 756 kB) Martainville, maio de 2008.
- ^ Fornecimento de lítio em Portugal (2017).
- ↑ Potencialidades do LÍTIO EM PORTUGAL DO NORTE (2004).
- ↑ Lítio europeu. Recuperado em 17 de março de 2021 .
- ↑ Ouro do futuro: Mina de lítio da Caríntia prestes a começar. Recuperado em 16 de julho de 2020 .
- ^ Projeto de lítio de Zinnwald. Deutsche Lithium, acessado em 17 de março de 2021 .
- ↑ Zacharias Zacharakis: Lítio: A montanha desperta . In: O tempo . Hamburgo, 13 de novembro de 2017 ( zeit.de [acessado em 5 de dezembro de 2017]).
- ↑ Alix Arnold: Paisagem grandiosa e cobiçada matéria-prima. O Salar de Tunupa / Uyuni, na Bolívia, é rico em beleza - e lítio. In: ila. Revista do Observatório da América Latina . 395, Bonn, maio de 2016, pp. 38–39.
- ^ Stephan Bogner: Prima Diamond Corp. adquire o projeto Green Energy em Utah com concentrações históricas de lítio de 1700 mg / L. Rockstone Research, 18 de fevereiro de 2015 ( PDF )
- ↑ A esperança branca . In: FAZ . 27 de janeiro de 2011, p. 19.
- ^ Sixie Yang e outros: Extração de metal de lítio da água do mar . In: Joule . 2018, doi : 10.1016 / j.joule.2018.07.006 .
- ↑ Água de mina como água valiosa - mineração encontra eletromobilidade (comunicado à imprensa do INM)
- ↑ Para onde foi todo o lítio. Em: Wissenschaft.de de 15 de agosto de 2006. A observação de um sistema estelar distante traz a solução para um enigma cosmológico .
- ↑ Sobre anãs marrons .
- ↑ Garik israelense, Elisa Delgado Mena, Nuno C. Santos, Sergio G. Sousa, Michel Mayor, Stephane Udry, Carolina Domínguez Cerdena, Rafael Rebolo, Sofia Randich: Depleção aumentada de lítio em estrelas semelhantes ao Sol com planetas em órbita. In: Nature . No. 462, 2009, pp. 189-191, doi: 10.1038 / nature08483 .
- ↑ Ulrich Wietelmann, Richard J. Bauer: lítio e compostos de lítio . In: Enciclopédia de Química Industrial de Ullmann . fita 21 , 2012, p. 344 , doi : 10.1002 / 14356007.a15_393 .
- ^ Terence Bell: Uma visão geral da produção comercial de lítio. The Balance, 11 de maio de 2018, acessado em 16 de dezembro de 2018 .
- ↑ zdf.de de 9 de setembro de 2018, E-Autos: Um único negócio aparentemente limpo, especialmente a seção “Problem Lithium”, acessada em 4 de maio de 2019.
- ↑ ARD: O carro elétrico pode salvar o meio ambiente?
- ^ Lítio no LME. Portal da Internet lme.com (London Metal Exchange online), 2020, site acessado em 21 de março de 2020.
- ↑ Clyde Smith: Tecnologia de bateria avançada, ETFs de mineração de lítio e grafite: ETF Global X Lithium & Battery Tech (NYSE: LIT), Amplify Advanced Battery Metals (NYSE: BATT). Portal da Internet born2invest.com, 10 de abril de 2019 (inglês)
- ↑ Lítio Global Solativo (SOLLIT). portal de internet investing.com (UK), site acessado em 22 de março de 2020
- ↑ Solactive Global Lithium Index , folheto informativo, de 2 de abril de 2020.
- ↑ a b K. Schubert: Um modelo para as estruturas cristalinas dos elementos químicos. In: Acta Crystallographica . 30, 1974, pp. 193-204, doi: 10.1107 / S0567740874002469 .
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Textbook of Inorganic Chemistry . 91ª - 100ª edição aprimorada e amplamente expandida. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3 , pp. 928-931.
- ↑ lítio em webelements.com, propriedades físicas .
- ↑ H. Malissa: A separação do lítio do magnésio em ligas de lítio-magnésio. In: Fresenius 'Journal of Analytical Chemistry . 171, No. 4, 1959, pp. 281-282, doi: 10.1007 / BF00555410 .
- ↑ M. Binnewies: General and Inorganic Chemistry. Spektrum Verlag, 2006, p. 328.
- ^ Marque J. Inverno : Ligação química. Oxford University Press, 1994, ISBN 0-19-855694-2 .
- ↑ M. Binnewies: General and Inorganic Chemistry. Spektrum Verlag, 2006, página 241.
- ↑ G. Audi, FG Kondev, Meng Wang, WJ Huang, S. Naimi: A avaliação NUBASE2016 das propriedades nucleares. In: Chinese Física C . 41, 2017, p. 030001, doi: 10.1088 / 1674-1137 / 41/3/030001 ( texto completo ).
- ↑ Richard Bauer: Lítio - já que não está no dicionário. In: Chemistry in Our Time . 19, No. 5, 1985, pp. 167-173, doi: 10.1002 / ciuz.19850190505 .
- ↑ Relatório sobre o teste da bomba de hidrogênio Castle Bravo (Engl.)
- ↑ Martin Volkmer: Conhecimento básico em energia nuclear. Inforum, 2006, ISBN 3-926956-44-5 , p. 39 ( PDF ( Memento de 17 de junho de 2012 no Internet Archive )).
- ↑ CC Bradley, CA Sackett, JJ Tollett, RG Hulet: Evidência de condensação de Bose-Einstein em um gás atômico com interações atrativas. In: Cartas de Revisão Física . 75, No. 9, 1995, pp. 1687-1690, doi: 10.1103 / PhysRevLett.75.1687 .
- ↑ S. Jochim, M. Bartenstein, A. Altmeyer, G. Hendl, S. Riedl, C. Chin, J. Hecker Denschlag, R. Grimm: Bose-Einstein Condensation of Molecules. In: Science . 302, No. 5653, 2003, pp. 2101-2103, doi: 10.1126 / science.1093280 .
- ↑ Script sobre baterias na TU Graz ( Memento de 24 de janeiro de 2009 no Internet Archive ) (PDF; 3,4 MB).
- ↑ J. Cade: Sais de lítio no tratamento da excitação psicótica. In: Med. J. Australia. 36, 1949, pp. 349-352. PMID 18142718 .
- ↑ T. Bschor: 66 anos de terapia psicofarmacêutica moderna. In: Neurology. 34, 2015, pp. 710-714.
- ↑ M. Schou: Tratamento com lítio da doença maníaco-depressiva. Thieme, 2001, ISBN 3-13-593304-0 .
- ↑ Gerhard N. Schrauzer, Krishna P. Shrestha: Lítio na água potável e as incidências de crimes, suicídios e prisões relacionados ao vício em drogas. In: Biological Trace Element Research . 25 de maio de 1990, pp. 105-113, PMID 1699579 .
- ↑ MJ Berridge: Trifosfato de inositol e diacilglicerol como segundos mensageiros. In: Biochemical Journal . 220, No. 2, 1984, pp. 345-360, PMC 1153635 (texto completo livre).
- ↑ DH Carney, DL Scott, EA Gordon, EF LaBelle: Fosfoinositídeos na mitogênese: a neomicina inibe, turnover de fosfoinositídeo estimulado por trombina e início da proliferação celular. In: Cell . 42, No. 2, 1985, pp. 479-488, PMID 2992800 .
- ^ R. Williams, WJ Ryves, EC Dalton, B. Eickholt, G. Shaltiel, G. Agam, AJ Harwood: A molecular cell biology of lithium. In: Biochem. Soc. Trans. 32, 2004, pp. 799-802, doi: 10.1042 / BST0320799 .
- ↑ Terapia com drogas psiquiátricas .
- ↑ Brigitte Woggon : Tratamento com drogas psicotrópicas. Huber, Bern 1998, pp. 77-84.
- ↑ T. Hafen, F. Wollnik: Efeito do carbonato de lítio no nível de atividade e período circadiano em diferentes cepas de ratos. In: Pharmacology Biochemistry & Behavior . 49, 1994, pp. 975-983, PMID 7886116 .
- ^ E. Bünning, I. Moser: Influência da valinomicina em movimentos circadianos da ligação de Phaseolus. In: Proc. Natl. Acad. Sci. EUA . 69, No. 9, 1972, página 2733, PMC 427027 (texto completo livre).
- ↑ W. Engelmann: O lítio retarda o relógio Kalanchoe. In: Jornal da Natureza Research B . 27, 1972, página 477 ( online ). PMID 4403319 .
- ↑ Compreendendo os alucinógenos. (Não está mais disponível online.) Ruprecht-Karls-Universität Heidelberg, arquivado do original em 17 de janeiro de 2012 ; acessado em 11 de junho de 2016 .
- ↑ Sean MJ McBride et al.: Reversão farmacológica e genética dos déficits cognitivos dependentes da idade atribuíveis à função diminuída da presenilina. In: The Journal of Neuroscience . 30, 28, 2010, pp. 9510-9522, doi: 10.1523 / JNEUROSCI.1017-10.2010 .
- ↑ Kim Zarse, Takeshi Terao, Jing Tian, Noboru Iwata, Nobuyoshi Ishii e Michael Ristow: A absorção de baixas doses de lítio promove a longevidade em humanos e metazoários. In: Eur J Nutr . 50 (5), 2011, pp. 387-389; doi: 10.1007 / s00394-011-0171-x ; PMID 21301855 ; PMC 3151375 (texto completo gratuito).
- ^ Fonte da juventude na água potável , Der Spiegel 10/2011.
- ^ Otto-Albrecht Neumüller (Ed.): Römpps Chemie-Lexikon. Volume 3: H-L. 8ª edição revisada e ampliada. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7 , pp. 2386-2387.
- ↑ Tabela Periódica: Lítio . Uniterra.de.
- ↑ PJ Pearce, DH Richards, NF Scilly: Uma alternativa de uma etapa para a reação de Grignard. In: J. Chem. Soc., Perkin Trans. 1 . 1972, pp. 1655-1660, doi: 10.1039 / P19720001655 .







![{\ displaystyle \ mathrm {Li ^ {+} + \ mathrm {e} ^ {-} \ {\ xrightarrow [{Eletrólise}] {(450-500) \, ^ {\ circ} C}} \ Li}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/467e9c877afa1b2a38b28c0a03a93ff0beb790c8)