acetona
| Fórmula estrutural | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Em geral | |||||||||||||||||||
| Sobrenome | acetona | ||||||||||||||||||
| outros nomes | |||||||||||||||||||
| Fórmula molecular | C 3 H 6 O | ||||||||||||||||||
| Descrição breve |
líquido incolor com odor adocicado |
||||||||||||||||||
| Identificadores / bancos de dados externos | |||||||||||||||||||
| |||||||||||||||||||
| propriedades | |||||||||||||||||||
| Massa molar | 58,08 g mol −1 | ||||||||||||||||||
| Estado físico |
líquido |
||||||||||||||||||
| densidade |
0,79 g cm -3 (20 ° C) |
||||||||||||||||||
| Ponto de fusão |
−95 ° C |
||||||||||||||||||
| ponto de ebulição |
56 ° C |
||||||||||||||||||
| Pressão de vapor |
|
||||||||||||||||||
| solubilidade |
miscível com água e muitos solventes orgânicos |
||||||||||||||||||
| Momento dipolo | |||||||||||||||||||
| Índice de refração |
1,3588 (20 ° C) |
||||||||||||||||||
| instruções de segurança | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG / Suíça: 500 ml m −3 ou 1200 mg m −3 |
||||||||||||||||||
| Dados toxicológicos | |||||||||||||||||||
| Tanto quanto possível e usual, unidades SI são usadas. Salvo indicação em contrário, os dados fornecidos aplicam-se às condições padrão . Índice de refração: linha Na-D , 20 ° C | |||||||||||||||||||
Acetona ou acetona [ at͡səˈtoːn ] é o nome comum do composto químico orgânico propanona ou dimetil cetona . A acetona é um líquido incolor e é utilizado como um aprótico polar solvente e como um material de partida para muitas sínteses em química orgânica. Com sua característica estrutural do grupo carbonila (> C = O), que carrega dois grupos metil , é a cetona mais simples .
Extração e apresentação
A acetona foi produzida pela primeira vez em 1606 por Andreas Libavius por aquecimento do acetato de chumbo (II) . Em 1661, Robert Boyle conseguiu conquistá-lo por meio da destilação a seco da madeira. Foi descrito pela primeira vez em 1610 no Tyrocinium Chymicum de Jean Beguin . Até meados do século 20, a fermentação acetona-butanol-etanol, descoberta e patenteada por Chaim Weizmann , era um processo importante também para a produção de acetona. A bactéria anaeróbia Clostridium acetobutylicum foi usada para produção industrial .
O processo de produção mais importante de acetona hoje é o processo de hidroperóxido de cumeno , que também é conhecido como síntese de fenol de Hock :
Aqui, o benzeno e o propeno são primeiro convertidos em isopropilbenzeno ( cumeno ) por uma alquilação de Friedel-Crafts em ácido . Este então reage com o oxigênio em uma reação radical para formar o hidroperóxido , que se decompõe em fenol e acetona durante o processamento ácido .
Outro processo de fabricação é a desidrogenação ou oxidesidrogenação do isopropanol .
Outra forma de produzir acetona é aquecer o acetato de cálcio ( 1 ), onde se decompõe em acetona ( 2 ) e óxido de cálcio ("destilação do sal de cal").
Este processo remonta à síntese histórica acima mencionada por Libavius em 1606.
propriedades
A acetona é um líquido incolor de baixa viscosidade com um odor característico levemente adocicado, altamente inflamável e forma uma mistura explosiva com o ar. O ponto de ebulição à pressão normal é 56 ° C. É miscível em todas as proporções com água e a maioria dos solventes orgânicos. A molécula de acetona mostra tautomerismo ceto-enólico ; seu valor de pK s é 20. acetona pode ser devido ao seu grupo carbonila polar com cátions também formam compostos complexos.
O composto forma misturas azeotrópicas com vários outros solventes . As composições azeotrópicas e os pontos de ebulição podem ser encontrados na tabela a seguir. Nenhum azeótropo é formado com água , etanol , 1-propanol , 2-propanol , n-butanol , benzeno , tolueno , etilbenzeno , éter dietílico , acetato de etila e acetonitrila .
| Azeótropos com vários solventes | ||||||||||||
| solvente | n- pentano | n- hexano | n- heptano | Ciclohexano | Metanol | clorofórmio | Tetracloreto de carbono | Éter diisopropílico | Acetato de metila | |||
| Conteúdo de acetona | dentro% | 21 | 59 | 90 | 67 | 88 | 22º | 89 | 61 | 50 | ||
| ponto de ebulição | em ° C | 32 | 50 | 56 | 53 | 55 | 64 | 56 | 54 | 55 | ||
Propriedades termodinâmicas
De acordo com Antoine, a função de pressão de vapor resulta de log 10 (P) = A− (B / (T + C)) (P em bar, T em K) com A = 4,42448, B = 1312,253 e C = −32,445 em a faixa de temperatura de 259,2 a 507,6 K.
| propriedade | Modelo | Valor [unidade] | Observações |
|---|---|---|---|
| Entalpia de formação padrão | Δ f H 0 líquido Δ f H 0 gás |
−249,4 kJ mol −1 −218,5 kJ mol −1 |
como um líquido como um gás |
| Entalpia de combustão | Δ c H 0 gás | −1821,4 kJ mol −1 | |
| Capacidade de calor | c p | 125,45 J mol −1 K −1 (25 ° C) 2,16 J g −1 K −1 (25 ° C) 75,02 J mol −1 K −1 (25 ° C) 1,29 J g −1 K −1 (25 ° C) C) |
como um líquido como um gás |
| Temperatura critica | T c | 508,15K | |
| Pressão crítica | p c | 47.582 bar | |
| Densidade crítica | ρ c | 4,63 mol·l −1 | |
| Fator acêntrico | ω c | 0,30653 | |
| Entalpia de fusão | Δ f H | 5,72 kJ mol −1 | no ponto de fusão |
| Entalpia de evaporação | Δ V H | 29,1 kJ mol −1 | no ponto de ebulição de pressão normal |
A dependência da entalpia de vaporização com a temperatura pode ser calculada de acordo com a equação Δ V H 0 = A e (−βT r ) (1 - T r ) β (Δ V H 0 em kJ / mol, T r = (T / T c ) temperatura reduzida) com A = 46,95 kJ / mol, β = 0,2826 e T c = 508,2 K na faixa de temperatura entre 298 K e 363 K. A capacidade de calor específico pode ser calculada na faixa de temperatura entre 5 ° C e 50 ° C por meio de uma função linear com c p = 1,337 + 2,7752 · 10 −3 · T (com c p em kJ · kg −1 · K −1 e T em K) podem ser estimados.
Pressão de vapor -Funk-ção de acetona
Dependência do calor de vaporização da acetona com a temperatura
Parâmetros relacionados à segurança
A acetona forma misturas de vapor e ar altamente inflamáveis. O composto tem um ponto de inflamação abaixo de -20 ° C. A faixa de explosão está entre 2,5% em volume (60 g / m³) como limite inferior de explosão (LEL) e 14,3% em volume (345 g / m³) como limite superior de explosão (UEL). Uma correlação dos limites de explosão com a função de pressão de vapor resulta em um ponto de explosão inferior de -23 ° C e um ponto de explosão superior de 8 ° C. Os limites de explosão dependem da pressão. Uma redução na pressão leva a uma redução na área de explosão. O limite inferior de explosão muda apenas ligeiramente até uma pressão de 100 mbar e só aumenta em pressões abaixo de 100 mbar. O limite superior de explosão diminui analogamente com a diminuição da pressão.
| Limites de explosão sob pressão reduzida (medido a 100 ° C) | ||||||||||||
| impressão | em mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | Dia 25 |
| Limite inferior de explosão (LEL) | em% por volume | 2,2 | 2,2 | 2,3 | 2,3 | 2,4 | 2,4 | 2,5 | 2,6 | 2,7 | 3,6 | 5.0 |
| em g m -3 | 53 | 53 | 53 | 55 | 57 | 58 | 59 | 61 | 63 | 86 | 119 | |
| Limite de explosão superior (UEL) | em% por volume | 14,3 | 14,0 | 13,7 | 13,4 | 13,2 | 13,1 | 13,1 | 13,1 | 12,5 | 10,3 | 9,0 |
| em g m -3 | 345 | 338 | 331 | 324 | 319 | 316 | 316 | 316 | 302 | 249 | 217 | |
| Pressão máxima de explosão sob pressão reduzida | ||||||||||||
| impressão | em mbar | 1013 | 800 | 600 | 400 | 300 | 200 | 100 | ||||
| Pressão máxima de explosão (em bar) | a 20 ° C | 9,3 | 7,5 | 5,5 | 3,6 | 2,7 | 1.8 | 0,8 | ||||
| a 100 ° C | 7,4 | 4,5 | ||||||||||
A pressão máxima de explosão é de 9,7 bar. Conforme a temperatura aumenta e a pressão de saída cai, a pressão máxima de explosão cai. A largura limite da lacuna foi determinada como sendo 1,04 mm (50 ° C). Isso resulta em uma atribuição ao grupo de explosão IIA. Com uma energia de ignição mínima de 1,15 mJ, as misturas vapor-ar são extremamente inflamáveis. A temperatura de ignição é 535 ° C. A substância cai, portanto, na classe de temperatura T1. Uma queda brusca na temperatura de ignição é observada sob pressão elevada. A condutividade elétrica é bastante baixa em 4,9 · 10 −7 S · m −1 .
| Temperaturas de ignição sob pressão elevada | ||||||||||||
| impressão | em dinheiro | 1 | 2 | 4º | 6,8 | 16,5 | ||||||
| Temperatura de ignição | em ° C | 535 | 345 | 290 | 265 | 250 | ||||||
Reações (seleção)
Iodinação de acetona
Como uma reação especial está aqui a iodação da acetona como um exemplo clássico de uma cinética de reação chamada ordem pseudo-zero. Como apenas a forma enol pode ser iodada, mas a acetona é quase 100% cetona, a concentração de 2-propenol durante a reação pode ser considerada constante. Sua ligação dupla C = C reage com o iodo dividindo um íon iodeto para formar um cátion mesomérico , que então transfere um próton para um íon iodeto.
O estabelecimento do equilíbrio ceto-enol é catalisado por ácido (e também por base). A iodação é, portanto, muito acelerada pelo iodeto de hidrogênio resultante ( autocatálise ).
Reação iodofórmica
Ao adicionar base, no entanto, ocorre a reação de iodofórmio :
Formação de dibenzalacetona
A acetona reage na presença de benzaldeído em uma solução alcalina para formar dibenzalacetona . A reação ocorre de acordo com o mecanismo geral de condensação de aldol .
Também pode ser sintetizada a benzalanilina - ela reage a anilina com a solução alcalina at-in, eliminando a acetona da água para a base de Schiff ( azometina ). Tanto a dibenzalacetona quanto a benzalanilina são substâncias valiosas porque têm ligações duplas muito reativas que podem ser atacadas por nucleófilos .
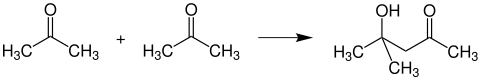
Formação de álcool de diacetona
Se duas moléculas de acetona são permitidas a dimerizar de uma maneira semelhante a aldol sob a influência de reagentes básicos, o álcool de diacetona é formado :
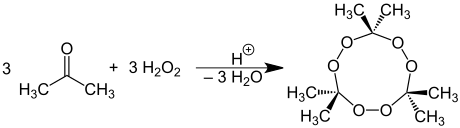
Formação de peróxido de acetona
A acetona reage com o peróxido de hidrogênio para formar peróxido de acetona propenso a detonação :
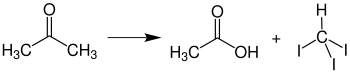
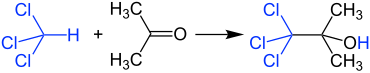
Reação com clorofórmio
A acetona e o clorofórmio não devem ser misturados em concentrações mais altas porque uma reação muito violenta ocorre na presença de vestígios de substâncias alcalinas, produzindo 1,1,1-tricloro-2-metil-2-propanol . Por esta razão, também, resíduos de solventes clorados e não clorados devem ser coletados separadamente no laboratório.
usar
A acetona é o material de partida para várias sínteses na indústria química. É usado principalmente para a produção de polimetilmetacrilato (PMMA), coloquialmente conhecido como vidro acrílico ou plexiglass. Para isso, a acetona é primeiro convertida em acetona cianidrina pela adição de ácido cianídrico , que se separa facilmente da água em meio ácido ( estabilização mesomérica da dupla ligação devido à conjugação à ligação tripla do grupo nitrila). O 2-metilpropenenitrila resultante é convertido em metacrilato de metila pela adição de uma mistura de ácido sulfúrico concentrado e metanol , que é polimerizado em vidro acrílico em uma etapa posterior.
A acetona é usada industrialmente como um precursor para a produção de álcool de diacetona por adição de aldol e, portanto, indiretamente como um precursor para o óxido de mesitila e metil isobutil cetona .

A acetona também é usada em pequenas quantidades como solvente útil para resinas , gorduras e óleos, breu , acetato de celulose, bem como removedor de esmaltes e cola plástica. Também é usado para remover a contaminação causada por espuma de construção , por exemplo, ao limpar pistolas de espuma PU. Dissolve muitas vezes seu volume em etino (acetileno).
Em alguns países, a acetona é adicionada em pequenas proporções (1: 2000 - 1: 5000) à gasolina ou diesel para obter uma combustão mais completa do combustível.
Na produção de placas de circuito fotoquímico , a acetona é usada para o desengraxamento final da placa de circuito antes da soldagem.
Soluções contendo acetona são usadas em odontologia para limpar superfícies de dentina preparadas e canais radiculares .
bioquímica
A acetona é um corpo cetônico formado no fígado que não pode ser metabolizado de forma significativa. Portanto, é liberado pelos pulmões ou, em casos excepcionais , pela urina ( acetonúria , um sintoma de diabetes mellitus ). Outros corpos cetônicos são o ácido acetoacético e o ácido 3-hidroxibutanóico . Eles podem ser processados no metabolismo e estão envolvidos no fornecimento de energia para os músculos.
toxicologia
A acetona causa ressecamento da pele ao desengordurá-la. Portanto, você deve lubrificar as áreas afetadas após o contato. A inalação de doses maiores causa irritação brônquica, cansaço e dor de cabeça. Doses muito altas têm efeito narcótico .
Hexadeuteroacetona
A acetona deuterada (fórmula empírica: C 3 D 6 O), também chamada de acetona-d 6 , é usada como solvente na espectroscopia de ressonância magnética nuclear (NMR).
As propriedades físicas são ligeiramente diferentes do composto não deuterado:
- Ponto de fusão: -93,8 ° C
- Ponto de ebulição: 55,5 ° C
- Densidade: 0,872 g / ml (25 ° C)
- Índice de refração: 1,355 (20 ° C)
Links da web
- Entrada para acetona no banco de dados de informações de produtos de consumo
Evidência individual
- ↑ Entrada sobre ACETONE na base de dados CosIng da Comissão da UE, acessada em 16 de fevereiro de 2020.
- ↑ a b c d e f g h i j k l m n o Entrada sobre acetona no banco de dados de substâncias GESTIS do IFA , acessado em 1 de fevereiro de 2016. (Requer JavaScript)
- ↑ Peter B. Fleming, Robert E. McCarley: Chemistry of Polynuclear Metal Halides. IV. Espectros eletrônicos de alguns derivados de nióbio e tântalo M 6 X 12 n + . In: Química Inorgânica . fita 9 , não. 6 , junho de 1970, p. 1347-1354 , doi : 10.1021 / ic50088a011 .
- ↑ Entrada em acetona. In: Römpp Online . Georg Thieme Verlag, acessado em 10 de novembro de 2014.
- ↑ David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90ª edição. (Versão na Internet: 2010), CRC Press / Taylor e Francis, Boca Raton, FL, Dipole Moments, pp. 9-52.
- ↑ David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90ª edição. (Versão na Internet: 2010), CRC Press / Taylor e Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-4.
- ↑ Entrada em acetona no inventário de classificação e rotulagem da Agência Europeia dos Produtos Químicos (ECHA), acessado em 1 de Fevereiro de 2016. Os fabricantes ou distribuidores podem expandir a classificação e rotulagem harmonizadas .
- ↑ Swiss Accident Insurance Fund (Suva): Valores limite - valores MAK e BAT atuais (pesquise 67-64-1 ou acetona ), acessado em 2 de novembro de 2015.
- ↑ chemgapedia.de , unidade de aprendizagem de síntese de acetona.
- ↑ a b I. M. Smallwood: Manual de propriedades de solventes orgânicos. Arnold, London 1996, ISBN 0-340-64578-4 , pp. 27-29.
- ↑ D. Ambrose, CHS Sprake, R. Townsend: Thermodynamic Properties of Organic Oxygen Compounds. XXXIII. A pressão de vapor da acetona. Em: J. Chem. Thermodyn. 6, 1974, pp. 693-700, doi: 10.1016 / 0021-9614 (74) 90119-0 .
- ↑ a b K. B. Wiberg, LS Crocker, KM Morgan: Thermochemical Studies of Carbonyl Compounds. 5. Entalpias de redução de grupos carbonil. In: J. Am. Chem. Soc. 113, 1991, pp. 3447-3450, doi: 10.1021 / ja00009a033 .
- ^ CB Miles, H. Hunt: Heats of Combustion. I. O calor da combustão da acetona. In: J. Phys. Chem. 45, 1941, páginas 1346-1359; doi: 10.1021 / j150414a002 .
- ↑ a b c R. Malhotra, LA Woolf: Propriedades termodinâmicas da propanona (acetona) a temperaturas de 278 K a 323 K e pressões de até 400 Mpa. In: J. Chem. Thermodyn. 23, 1991, pp. 867-876, doi: 10.1016 / S0021-9614 (05) 80282-4 .
- ↑ a b J. Chao: Propriedades termodinâmicas dos principais compostos orgânicos de oxigênio na faixa de carbono C 1 a C 4 . Parte 2. Propriedades ideais do gás. In: J. Phys. Dados de referência química . 15, 1986, pp. 1369-1436, doi: 10.1063 / 1.555769 .
- ↑ a b c A. N. Campbell, RM Chatterjee: As constantes críticas e densidades ortobáricas de acetona, clorofórmio, benzeno e tetracloreto de carbono . In: Canadian Journal of Chemistry . 47, 1969, pp. 3893-3898, doi : 10.1139 / v69-646 .
- ↑ J. Schmidt: Projeto de válvulas de segurança para sistemas polivalentes de acordo com a ISO 4126-10. In: Chem. Ing. Techn. 83, 2011, pp. 796-812, doi: 10.1002 / cite.201000202 .
- ↑ KK Kelley: As capacidades de aquecimento do álcool isopropílico e acetona de 16 a 298 ° K e as entropias e energias livres correspondentes. In: J. Am. Chem. Soc. 51, 1929, pp. 1145-1150, doi: 10.1021 / ja01379a022 .
- ^ A b V. Majer, V. Svoboda: Entalpias da vaporização de compostos orgânicos: Uma revisão crítica e uma compilação de dados. Blackwell Scientific Publications, Oxford 1985, página 300.
- ↑ a b c d e E. Brandes, W. Möller: Safety-related parameters. Volume 1: Líquidos e gases inflamáveis. Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b c d D. Pawel, E. Brandes: Relatório final sobre o projeto de pesquisa, a dependência dos parâmetros relacionados à segurança na pressão abaixo da pressão atmosférica. ( Memento de 2 de dezembro de 2013 no Internet Archive ), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- ↑ JB Fenn: Limite enxuto de inflamabilidade e energia mínima de ignição por faísca. Fluidos comerciais e hidrocarbonetos puros. In: Ind. Eng. Chem. 43, 1951, páginas 2865-2869; doi: 10.1021 / ie50504a057 .
- ↑ HF Calcote, CA Gregory, CM Barnett, RB Gilmer: Spark Ignition - Effect of Molecular Structure. In: Ind. Eng. Chem. 44, 1952, pp. 2656-2662; doi: 10.1021 / ie50515a048 .
- ↑ Regra técnica para substâncias perigosas TRGS 727, folheto BG RCI T033 Evitar riscos de ignição devido a cargas eletrostáticas , status de agosto de 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6 .
- ^ FA Carey, RJ Sundberg: Química orgânica. Wiley-VCH Verlag, 2004, ISBN 3-527-29217-9 .
- ↑ Lutz Roth, Ursula Weller: reacções químicas perigosas , ISBN 3-609-73090-0 , segurança ecomed; 2005.
- ↑ Identificadores externos ou links de banco de dados para Acetona Deuterada : Número CAS:666-52-4 , número da CE: 211-563-9, ECHA InfoCard: 100.010.514 , PubChem : 522220 , ChemSpider : 455535 , Wikidata : Q1032873 .
- ↑ Folha de dados da acetona-d6 da Sigma-Aldrich , acessada em 31 de agosto de 2019 ( PDF ).
- ↑ Comparado com 0,791 g / ml (25 ° C) para o composto não deuterado. Folha de dados de acetona da Sigma-Aldrich , acessada em 31 de agosto de 2019 ( PDF ).