Cosmoquímica

A Cosmoquímica - até mesmo chamada de Astroquímica - preocupa-se com a formação e distribuição de elementos e compostos químicos no universo . Os elementos químicos surgem no interior das estrelas ( nucleossíntese ), compostos químicos, porém, em gases cósmicos e nuvens de poeira , em planemos , luas , cometas , asteróides e objetos semelhantes mais frios.
A cosmoquímica é um ramo moderno e importante da física e da química e está fortemente ligada à astrofísica , especialmente à física de estrelas e supernovas . Também desempenha um papel importante na planetologia e na tentativa de compreender a origem e o desenvolvimento químico do nosso sistema solar e outros planemos (até a origem da vida - ver evolução química ).
No entanto, uma vez que as estrelas e quase todos os outros corpos celestes estão a uma distância inacessível para nós, fica-se restrito a certos métodos no que diz respeito à análise química , principalmente métodos instrumentais de espectroscopia e análise (espectral) , em que a radiação proveniente dos objetos ( ultravioleta , luz visível , infravermelho ).
Especificamente, a Cosmoquímica não está envolvida na nucleossíntese, mas com a distribuição elementar e isotópica em nosso sistema solar: Uma grande contribuição para isso vem da pesquisa de meteoritos , visto que meteoritos ainda possuem a composição química original dos primórdios da formação de nosso sistema solar. sistema. Algumas amostras de material extraterrestre da lua, poeira de cometa, vento solar e - espera-se - amostras de outros planetas, luas e asteróides também estarão acessíveis a partir de viagens espaciais (não tripuladas).
A cosmoquímica foi fundada na década de 1950 por Friedrich-Adolf Paneth .
Exemplo: um projeto “cosmoquímico”
A maneira como a cosmoquímica funciona (astrofísica, astroquímica, planetologia) pode ser ilustrada usando um exemplo mais recente de viagens espaciais não tripuladas. Normalmente os cosmoquímicos trabalham na avaliação de uma análise espectral ou espectroscopia : aqui eles podem usar espectros de radiação da "luz" de corpos celestes distantes (principalmente estrelas) para inferir sua composição química.
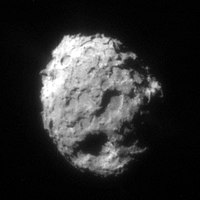
Desde o primeiro pouso na lua, amostras de material extraterrestre agora também podem ser capturadas diretamente do espaço por sondas espaciais e trazidas à Terra para análise direta. A missão da NASA " Stardust " tornou possível não apenas fotografar o asteróide Annefrank e o cometa Wild 2 , mas também capturar a poeira cometária. Em 2 de janeiro de 2004, Stardust voou além do cometa Wild 2 a uma distância de 240 km e uma velocidade relativa de 6,1 km / s. A sonda obteve várias imagens do cometa e coletou seu material de coma. Depois de retornar à Terra, a cápsula Stardust foi trazida para o centro de controle da NASA em Houston e aberta lá. Em Houston, a condição do aerogel foi verificada , um sólido extremamente leve no qual as partículas de poeira do cometa Wild 2 foram reduzidas a velocidade e transportadas. Uma pequena quantidade de poeira cometária estava então disponível para vários grupos de cientistas - por exemplo, o Instituto de Planetologia de Münster . Lá, a composição química das partículas de poeira pode ser examinada diretamente. Espera-se que isso forneça novos insights sobre a formação de nosso sistema solar 4,6 bilhões de anos atrás, porque o cometa Wild 2 só se moveu nas áreas externas desde o início do sistema solar (não foi até 1974 que a gravidade do o planeta gigante Júpiter conseguiu sair de sua antiga trilha lançada). Em missões anteriores em cometas, pesquisadores em cosmoquímica encontraram compostos de carbono complexos usando análise espectral . Eles ainda não devem ser igualados à vida, mas talvez tenham dado o ímpeto para a origem da vida na terra.
A formação dos elementos químicos

A formação dos núcleos atômicos ( nuclídeos ) e os elementos químicos são descritos em detalhes no artigo Nucleossíntese . Como resultado, os elementos químicos hidrogênio e hélio foram criados diretamente após o Big Bang por meio da nucleossíntese primordial. Todos os tipos de átomos mais pesados se formaram dentro das estrelas fixas (nucleossíntese estelar) e durante as explosões de supernova . No final de seu tempo de combustão, estrelas muito massivas explodem e lançam grandes quantidades de elementos pesados no espaço. Por exemplo, a supernova SN 2006gy na galáxia NGC 1260 tinha 150 massas solares e quando explodiu soprou cerca de 20 massas solares de níquel no universo.
A distribuição dos elementos no cosmos
A distribuição de frequências cosmoquímicas dos tipos de átomos pode ser explicada de acordo com a história das origens dos elementos descritos em “ nucleossíntese ”. A abundância do elemento difere dependendo da área para a qual você está olhando: no entanto, de longe o elemento mais comum em todo o universo é o hidrogênio - é bastante raro na Terra, mas encontrado novamente com frequência em humanos.
O hidrogênio e o hélio dominam o espaço , pois ambos foram criados durante o Big Bang . De 1000 átomos no universo, 900 são átomos de hidrogênio, outros 99 átomos são átomos de hélio. Portanto, apenas um átomo em 1000 não é hidrogênio ou hélio. Todos os outros tipos de átomos (exceto lítio , berílio e boro ) se originaram em estrelas (veja acima e abaixo da nucleossíntese). Ao mesmo tempo, átomos com um número par de prótons foram formados, por exemplo , oxigênio , néon , ferro ou enxofre , que são, portanto, mais comuns em comparação com outros elementos com um número ímpar de prótons.
Para cada 1 trilhão de átomos de hidrogênio (H) - ou seja, 10 12 átomos de H cada - há 10 10,8 átomos de hélio, 10 8,8 átomos de oxigênio, 10 8,6 átomos de carbono e 10 8,0 átomos de nitrogênio, mas além de cerca de 10 7 cada , 9 de ferro e átomos de néon e 10 7,4 átomos de silício também apenas 10 1,7 de chumbo, 10 0,7 de ouro e 10 0,3 átomos de prata. A metalicidade das estrelas da 1ª geração (População II) com uma idade superior a 10 bilhões de anos é diferente: elas têm um total de 1/1000 elementos mais pesados do que corresponde à "distribuição normal" no espaço dada aqui.
Matéria interestelar - do ponto de vista cosmoquímico
A matéria interestelar contém os elementos químicos em distribuições semelhantes às do nosso Sol e de outras estrelas da população I. Aqui, porém, os átomos têm seus elétrons externos devido às temperaturas mais baixas, de modo que podem surgir compostos químicos, gases e poeiras entre os sistemas estelares.
Entre as estrelas existe gás hidrogênio (neutro) com densidade de 0,8 átomos de H / cm 3 ou 1,3 × 10 −24 g / cm 3 . Algumas áreas são mais pobres em hidrogênio (centro galáctico), em outros lugares há densidades (neblina, nuvens) - e ocasionalmente há até áreas luminosas, estimuladas a brilhar por ex. T. intensa irradiação UV de estrelas vizinhas (nebulosa de emissão) ou reflexão (nebulosa de reflexão).
No estado de equilíbrio entre a velocidade de produção e a taxa de decomposição, moléculas orgânicas complexas são agora formadas em algumas nebulosas, mas muitas vezes são imediatamente quebradas novamente pela radiação cósmica ionizante. No entanto: Eles existem e, protegidos por nuvens de poeira, moléculas como água, amônia, metano e formaldeído (metanal) podem ter vidas úteis de décadas, nitrogênio e monóxido de carbono até 1000 anos. Eles também podem sobreviver por longos períodos de tempo (até 100.000 anos) congelando-se na superfície dos grãos de poeira. Mesmo em densidades de apenas 50 átomos / cm 3 , as colisões atômicas podem resultar em moléculas como hidrogênio e monóxido de carbono, radicais hidroxila ou monociano (CN).

Em meteoritos , os cosmoquímicos encontraram até alcanos como 2,6,10,14-tetrametilpentadecano, aromáticos como benzeno, tolueno, xilenos e naftaleno, ácidos graxos com 14-28 átomos de carbono, tiofenos, p- diclorobenzeno, aminoácidos como prolina , ácido aspártico, glicina, alanina e ácido glutâmico (Meteorit Murchison, 1969) e até mesmo adenina e guanina. A descoberta de aminoácidos de origem extraterrestre em 1970 foi considerada uma sensação definitiva, pois são os blocos básicos de construção da vida terrena.
A formação dessas moléculas orgânicas é explicada por vários mecanismos. Miller e Urey irradiaram misturas de gases de metano, amônia e água. Íons e radicais produzidos por radiólise formam íons com até sete átomos de carbono. Os polímeros podem então crescer via eteno, e até mesmo grupos carboxila e amino podem ser incorporados via radicais como NH 2 * e H 2 O * e reagir posteriormente para formar aminoácidos de acordo com vários mecanismos:
- a cianidrina mecanismo (alcanal + amoníaco + ácido cianídrico para: nitrilo + água, mais a reacção do nitrilo R-CH (CN) NH 2 com água para formar o aminoácido),
- de acordo com Sanchez (NC-CCH + amônia para NC-CH = CH-NH 2 + HCN e posteriormente com água com eliminação de amônia para asparagina ),
- via síntese Fischer-Tropsch (CO reage com hidrogênio a 10 −6 a 10 −2 atm e 450-750 Kelvin para metano ou alcanos superiores e água, catalisado por Ni, Fe, magnetita e / ou silicatos contendo água na poeira grãos - e com uma mistura cósmica de C: H: O de cerca de 1: 2000: 1,7, a 10 −4 atm e cerca de 400 Kelvin, mesmo aminoácidos , purinas , pirimidinas e semelhantes podem ser formados desta forma - simulado em laboratórios terrestres ).
Condições ainda melhores para a construção prevalecem naturalmente nas superfícies planetárias protegidas por atmosferas. Do ponto de vista astroquímico, é altamente provável que haja uma série de lugares nas profundezas do espaço para a formação de moléculas bioquímicas, na verdade para a formação da própria vida, e provavelmente já existiram por um longo tempo (no entanto, o o problema de estabelecer contatos com civilizações extraterrestres não reside na falta, evidência irrefutável de sua existência - mas na aparentemente intransponível grande distância entre eles).
Matéria terrestre - vista cosmoquimicamente
A distribuição de frequência dos elementos no cosmos como um todo pode mudar muito localmente. Um desses processos que muda essa distribuição média é a gravidade. É a força pela qual o sistema solar emergiu de uma nuvem giratória de gás e poeira ( hipótese nebular de Pierre-Simon Laplace , originalmente formulada por Immanuel Kant em 1755 em sua obra História Natural Geral e Teoria do Céu , coletivamente Kant-Laplace- Teoria ).
Formação dos sistemas terrestre, planetário e solar
De acordo com as visões atuais, cerca de 4,6 bilhões de anos atrás, em vez de nosso sistema solar, uma extensa nuvem de matéria se moveu ao redor do centro da galáxia. A nuvem consistia em mais de 99% dos gases hidrogênio e hélio e uma pequena proporção de partículas de poeira de tamanho micrométrico feitas de elementos e compostos mais pesados , como água , monóxido de carbono , dióxido de carbono , outros compostos de carbono , amônia e compostos de silício . O hidrogênio e a maior parte do hélio já haviam sido criados durante o Big Bang . Os elementos e compostos mais pesados foram criados dentro das estrelas e liberados quando explodiram. Partes da nuvem de matéria se contraíram devido à sua própria gravidade e se condensaram. O ímpeto para isso poderia ter sido a explosão de uma supernova relativamente próxima , cujas ondas de pressão migraram através da nuvem. Essas densificações levaram à formação de provavelmente várias centenas ou mesmo milhares de estrelas em um aglomerado de estrelas , que provavelmente se desintegrou em estrelas livres simples ou duplas após algumas centenas de milhões de anos.
Uma vez que o momento angular deve ser mantido durante a contração , uma rotação já mínima da nuvem em colapso aumentou, semelhante a como uma patinadora artística consegue uma rotação rápida colocando os braços. As forças centrífugas resultantes atuando externamente fizeram com que a nuvem se desenvolvesse em um disco giratório nas áreas externas.
No entanto, quase toda a matéria na nuvem caiu no centro e formou uma proto - estrela que continuou a entrar em colapso até que o processo de fusão nuclear foi iniciado: nosso sol foi formado. No disco protoplanetário remanescente , a aglomeração de partículas de poeira (coagulação) levou à formação de planetesimais. Os planetesimais são os precursores e os blocos de construção dos planetas . Eles são formados por acreção , um processo pelo qual partículas microscópicas de poeira de uma nebulosa pré - solar (o precursor de um sistema solar ) se aglomeram em partículas maiores . Se estas partículas colidem a baixa velocidade , eles ficar juntos devido a ligações químicas ou superfície de adesão.
Essas estruturas com o tamanho de um quilômetro em breve possuíam massa suficiente para se combinar com outros planetesimais para formar objetos maiores devido à sua gravitação. Os objetos mais pesados exercem as maiores forças gravitacionais, atraem matéria de uma grande área e podem, assim, crescer ainda mais rápido. O “Protojúpiter” finalmente perturbou outros planetesimais com seu campo gravitacional e influenciou seu crescimento. Aparentemente, também evitou a formação de um corpo maior entre as órbitas de Marte e Júpiter, o que levou à formação do cinturão de asteróides. Em apenas 100.000 anos, os planetesimais do sistema solar inicial poderiam evoluir para corpos planetários do tamanho da lua da Terra ou do planeta Marte .
Processos semelhantes na formação do sistema planetário devem ter ocorrido em outras partes do espaço. Muitos exoplanetas e planemos foram descobertos nos últimos anos. Aqui, também, os elementos voláteis e menos voláteis condensaram-se em compostos químicos no espaço, e muitos astrônomos e astroquímicos presumem que existem planemos que se movem em zonas de temperatura moderada em torno de suas respectivas estrelas fixas. Assim, é concebível que uma química extraterrestre também produzisse vida nas profundezas inacessíveis do cosmos.
A química do sistema solar
Os sistemas solares são criados pela contração gravitacional de discos de matéria giratórios em forma de disco . Cálculos termodinâmicos em relação a esse disco, que esfria cada vez mais rápido e mais leve a partir do centro, mostram que a condensação ocorre quando a pressão parcial p (i) e a pressão de vapor de uma substância i se igualam. A pressão parcial de um elemento no gás cósmico é matematicamente igual ao produto de sua frequência A (i) em relação à do hidrogênio A (H2), multiplicado pela pressão total Pg do gás: p (i) = A ( i) / A (H2) x Pg .
Se a pressão de vapor p de um elemento aparece como uma função da temperatura de acordo com Clausius-Clapeyron, então quando a pressão parcial e a pressão de vapor do elemento são equacionadas, sua temperatura de condensação pode ser calculada (isto é: log po = -A / T + B, - onde o fator A é a é a entalpia de evaporação dividida por 2,3 x R e B é a entropia de evaporação dividida por 2,3 x R com R como a constante geral do gás).
Aqui está o resultado desse cálculo, começando com a temperatura de condensação mais alta com resfriamento progressivo: o elemento ósmio já condensa em temperaturas em torno de 1860 K, cerca de 1780 óxido de zircônio IV e rênio, cerca de 1700 óxido de alumínio, cerca de 1560-1500 titanato de cálcio ( perovskita), bem como gehlenita (um silicato) e terras raras (U, Th, Ta, Nb), por volta de 1390 os metais ferromagnéticos (Fe, Ni, Co), em 1370-1250 silicatos de magnésio e os metais cobre, germânio e gálio (em liga com Fe) assim como silicatos alcalinos (com CaAl2Si2O8), em 1100-700 K prata (Ag) e abaixo de 750 K há oxidação do ferro condensado (em minerais como FeO + FeS).

Em regiões um pouco mais frias, mais distantes do sol primordial, chumbo, bismuto, índio e tálio condensados a 600-400 K; silicatos hidratados cristalizaram de 350 K e - na região dos gigantes gasosos mais distantes do sol - gelo de água (então NH 4 SH, a <140 Kelvin, a <100 K hidrato de amônia sólida, a <60 Kelvin de hidrato de metano e apenas em temperaturas mais baixas de <20 Kelvin (também metano sólido e argônio).
Durante a condensação, ocorre o fracionamento, ou seja, ao "congelar" as substâncias são classificadas de acordo com sua densidade, tanto dentro de pequenos aglomerados (côndrulos, meteoritos) quanto em grande escala (planetesimais: fora de gigantes gasosos posteriores como Júpiter e Saturno ou " a neve aglomera ") como cometas, planetas mais compactos por dentro, como Mercúrio e Vênus). As substâncias também se separam nos planetas primordiais brilhantes (afundamento dos metais no núcleo, subsequente resfriamento das crostas externas de silicato).
Isso explica a estrutura química atual de nosso sistema solar, desde os planetas rochosos internos aos gigantes gasosos frios e externos até os objetos mais distantes no cinturão de Kuiper e na nuvem de Oort da cosmoquímica.
De acordo com Oort (1950), os cometas se originam de um reservatório de 0,1-0,01 massas solares a uma distância de cerca de 50.000 UA. Chegando a 1 UA próximo ao sol, eles desenvolvem halos e - na vizinhança imediata do núcleo - comas com velocidades de expansão de 500 m / s, cuja densidade de gás varia de 10 14 moléculas / cm 3 perto do núcleo a 100 moléculas / cm 3 do lado de fora . O gás e as partículas de poeira são expulsas pelo vento solar e formam o íon do cometa e a cauda de poeira.
Os espectros de emissão das comas foram examinadas em detalhe, e a Giotto sonda foi capaz de voar através do coma do Halley cometa incólume. A uma distância de <2 UA, a coma do cometa mostra bandas de ciano, radicais OH, oxigênio neutro, sódio e - mais perto de 1 UA do núcleo - linhas dos elementos Cr, Mn, Fe, Co, Ni, Cu, K e Ca, os radicais NH e CH e os gases metil ciano, HCN e água. Os radicais CN podem ter sido criados por fotodissociação de metil ciano, os radicais NH * por fotólise de hidrazina ou de aminas como metilamina, de ácido isociânico (HNCO), metilenoimina H 2 C = NH ou de formamida. Radicais como C2 e C3 também foram descobertos. Eles provavelmente se originam do acetileno e do diazometilacetileno. Moléculas ionizadas de monóxido de carbono, dióxido de carbono, água e nitrogênio também foram detectáveis.
Com relação aos materiais semelhantes ao silicato, pode-se calcular que os grãos de poeira cometária são perdidos devido à pressão de radiação do sol e que seu diâmetro deve, portanto, ser inferior a 10 -6 cm. No início, os cometas eram considerados “bolas sujas de gelo”. No entanto, quando muito pouco metano foi encontrado no cometa Kohoutek, decidiu-se que eles não poderiam ter se originado do resfriamento, gás solar, mas sim conter componentes principais, como água, monóxido de carbono, nitrogênio, bem como cianeto de hidrogênio, cianeto de metila e poeira - materiais feitos de profundidades inacessíveis do espaço, o gás interestelar.
Matéria terrestre
Na Terra, a distribuição dos elementos é diferente da dos cometas, nos planetas gasosos distantes ou mesmo no cosmos em geral. Olhando para a crosta terrestre , o oxigênio ligado (O) domina com uma fração de massa de 49,2%, seguido por silício (Si, 25,7%), alumínio (Al 7,5%), ferro (Fe 4,7%), Cálcio (Ca 3,4%) , sódio (Na 2,6%), potássio (K 2,4%), magnésio (Mg 1,9%), hidrogênio (H 0,9%) e titânio (Ti 0, 6%). todos os outros elementos têm apenas uma fração de massa inferior a 0,2%.
Se você olhar para a Terra inteira com seu núcleo, surge uma imagem ligeiramente diferente. Os elementos mais comuns em toda a terra são ferro (Fe, 35%) antes do oxigênio (30%), silício (15%) e magnésio (13%), seguido por níquel , enxofre , cálcio , alumínio e outros (cada um abaixo de três por cento).
Nossa biomassa - analisada cosmoquimicamente
Os seres humanos são compostos de forma diferente do espaço e da terra: eles consistem principalmente de hidrogênio, oxigênio, carbono e nitrogênio, juntamente com sódio , magnésio , potássio , cálcio , fósforo e enxofre , esses elementos constituem 99,996% de todos os átomos em um corpo humano ( os primeiros estudos sistemáticos da abundância do elemento vêm de Victor Moritz Goldschmidt , depois dele a representação gráfica da abundância do elemento é chamada de diagrama de Goldschmidt ).
Os cosmoquímicos presumem que inicialmente apenas poucos ou nenhum elemento de luz (incluindo carbono, nitrogênio e oxigênio) foram "deixados" quando o sistema solar foi formado na Terra e em todos os outros planetas próximos ao sol por causa das temperaturas relativamente altas e os efeitos do vento solar . De acordo com essa teoria, todos esses elementos, que hoje constituem a parte principal da biosfera, teriam sido liberados das áreas externas do sistema solar por impactos de cometas por algum tempo após os protoplanetas terem esfriado um pouco. Uma vez que grandes eventos de impacto de corpos celestes foram constantemente repetidos durante as primeiras centenas de milhões de anos após a formação do sistema solar, os sistemas vivos que já estavam se desenvolvendo naquela época teriam sido repetidamente destruídos por esterilizações globais causadas por grandes colisões. O desenvolvimento da vida só pôde começar depois que a água líquida foi capaz de persistir pelo menos nas partes mais profundas dos oceanos.
Devido ao lento resfriamento da Terra, o vulcanismo resultante (liberando gás do interior da Terra) e a distribuição global da matéria dos cometas impactados, uma atmosfera foi estabelecida. Os principais componentes esperados são vapor de água (até 80%), dióxido de carbono (até 20%), sulfeto de hidrogênio (até sete por cento), amônia e metano.
No entanto, a origem real da água não é totalmente indiscutível. Especialmente a partir de água, metano e amônia, nas condições da Terra primitiva, podem formar-se pequenas moléculas orgânicas (ácidos, álcoois, aminoácidos) e, posteriormente, polímeros orgânicos (polissacarídeos, gorduras, polipeptídeos), que não são estáveis na atmosfera oxidante.
A alta radiação ultravioleta causou uma quebra fotoquímica das moléculas de água, metano e amônia, o que causou o acúmulo de dióxido de carbono e nitrogênio. A maioria dos gases leves, como hidrogênio ou hélio, evaporou para o espaço, enquanto grandes quantidades de dióxido de carbono se dissolviam nos oceanos, acidificando sua água e reduzindo o pH para cerca de 4. O nitrogênio inerte e moderadamente solúvel N 2 permaneceu inalterado, acumulou-se ao longo do tempo e formou o principal componente da atmosfera há cerca de 3,4 bilhões de anos.
A precipitação do dióxido de carbono com íons metálicos na forma de carbonatos e o posterior desenvolvimento de organismos vivos que assimilaram o dióxido de carbono levaram a uma redução na concentração de CO 2 e um novo aumento nos valores de pH das águas. O oxigênio O 2 desempenha apenas o papel principal no desenvolvimento posterior de nossa atmosfera atual. Foi formado pelo aparecimento de seres vivos com fotossíntese oxigenada por cerca de 3,5 bilhões de anos; presumivelmente, eram cianobactérias ou procariotos semelhantes a cianobactérias.
Biomoléculas
A evolução química presumivelmente ocorreu de tal forma que moléculas orgânicas complexas - compostos de carbono - foram formadas a partir dos elementos acumulados na terra emergente. A formação prebiótica das moléculas orgânicas complexas pode ser dividida aproximadamente em três etapas:
- Formação de moléculas orgânicas simples ( álcoois , ácidos carboxílicos , heterociclos como purinas e pirimidinas ) a partir de substâncias inorgânicas.
- Formação dos blocos de construção básicos ( açúcares simples , aminoácidos , pirroles , ácidos graxos , nucleotídeos ) de moléculas orgânicas complexas a partir de moléculas orgânicas simples.
- Criação das moléculas orgânicas complexas a partir dos blocos de construção básicos.
A análise elementar dessas moléculas leva à questão de quais compostos inorgânicos eram necessários para sua formação. Estes deveriam estar presentes na redutora atmosfera primordial da terra - na distribuição e sob as condições de reação que permitiram quimicamente o surgimento dos primeiros seres vivos.
Uma forma particularmente intensa de envolvimento de minerais e rochas na síntese prebiótica de moléculas orgânicas deve ter ocorrido na superfície dos minerais de sulfeto de ferro. O cenário para a evolução química inicial da vida foi desenvolvido por Günter Wächtershäuser desde o início dos anos 1980 .
De acordo com isso, a vida na terra teria surgido na superfície de minerais ferro-enxofre (o mundo ferro-enxofre ESW), ou seja, em sulfetos que ainda são formados hoje por meio de processos geológicos em vulcões do fundo do mar e ainda eram essenciais no início dias da terra devem ter ocorrido com mais freqüência (» fumantes negros «).
Afinal, o ácido ribonucléico (RNA) forma uma molécula vital para a criação da vida. A hipótese do mundo do RNA foi proposta pela primeira vez por Walter Gilbert em 1986 . Essa suposição pode ser derivada da capacidade do RNA de armazenar, transferir e reproduzir informações genéticas, bem como de catalisar reações como ribozimas. Em um ambiente evolutivo, essas moléculas de RNA ocorreriam com mais frequência e preferencialmente se reproduzem. Devido a várias propriedades, acredita-se que o RNA seja mais antigo que o DNA.
Veja também
literatura
- EM Burbidge, GR Burbidge, WA Fowler, F. Hoyle: Synthesis of the Elements in Stars. In: Rev. Mod. Phys. 29. 1957, p. 547 ( link direto para download de PDF ).
- Paola Caselli, Cecilia Ceccarelli: Nossa herança astroquímica , em: The Astronomy and Astrophysics Review, outubro de 2012, 20:56, 1-68, também online em Arxiv.org, Inglês, PDF
- CE Rolfs , WS Rodney: Caldeirões no Cosmos. Univ. of Chicago Press, 1988
- Heinz Oberhummer : Cores e estrelas. Barth, Leipzig 1993, ISBN 3-335-00319-5
- Wolfgang Kiesl: Cosmochemistry. Springer, Viena 1979, ISBN 3-211-81527-9
- Charles R. Cowley: Uma introdução à cosmoquímica. Cambridge Univ. Press, Cambridge 1995, ISBN 0-521-41538-1
- César Esteban: Cosmoquímica - o cadinho dos elementos. Cambridge University Press, Cambridge 2004, ISBN 0-521-82768-X
- Andrew M. Shaw: Astrochemistry - from astronomy to astrobiology. Wiley & Sons, Chichester 2006, ISBN 0-470-09136-3
- DD Clayton: manual de isótopos no cosmos. Cambridge Univ. Press, Cambridge 2003, ISBN 0-521-82381-1
- Thomas Henning : Astromineralogy. Springer, Berlin 2003, ISBN 3-540-44323-1
Links da web
- Astrochemistry.eu, fórum online da UE no campo da astroquímica e física observacional e de laboratório
- Grupo de pesquisa cosmoquímica, Universidade de Colônia
- O astroquímico
- Laboratório de astroquímica no Goddard Space Flight Center da NASA
- The Big Picture-Cosmochemistry (PDF; 2,4 MB) William M. White, Cornell University 2005, Geochemistry (pdf, 58 p., Acessado em 1 de janeiro de 2011; 4 MB)