Hiperparatireoidismo
| Classificação de acordo com CID-10 | |
|---|---|
| E21.0 | Hiperparatireoidismo primário |
| E21.1 | Hiperparatireoidismo secundário |
| E21.2 | Hiperparatireoidismo terciário, quaternário ou quadrático |
| CID-10 online (OMS versão 2019) | |
O hiperparatireoidismo ( HPT ) é um distúrbio regulatório das células epiteliais ( glândulas paratireoides ). O hiperparatireoidismo é caracterizado por uma formação aumentada de hormônio da paratireóide (hormônio da paratireóide) , que regula o nível de cálcio no sangue .
Se a formação aumentada de hormônio da paratireoide é baseada em um tumor benigno ( adenoma ) da glândula paratireoide, fala-se de glândulas paratireoides primárias hiperativas ( hiperparatireoidismo primário ). O hiperparatireoidismo primário é caracterizado por um nível elevado do hormônio da paratireóide e um aumento do cálcio sérico.
Se a formação aumentada de hormônio da paratireoide é a resposta adequada das glândulas paratireoides a um cálcio sérico reduzido ( hipocalcemia , por exemplo, com deficiência de vitamina D ), fala-se de hiperparatireoidismo secundário . O hiperparatireoidismo secundário é caracterizado por um nível elevado do hormônio da paratireoide com baixo cálcio sérico. Uma causa importante de hiperparatireoidismo secundário é a diminuição da ativação da vitamina D devido à doença renal crônica .
O hiperparatireoidismo secundário de longo prazo pode levar a um aumento inadequado do hormônio da paratireoide devido à superestimulação crônica das glândulas paratireoides. Também aqui, os níveis de hormônio da paratireóide e o cálcio sérico estão aumentados, mas fala-se de hiperparatireoidismo terciário . O hiperparatireoidismo terciário pode ser diferenciado do hiperparatireoidismo primário pela história médica .
As consequências do hiperparatiroidismo, que constituem o quadro clínico da ostite fibrosa generalisata , são a degradação da substância óssea devido ao aumento da liberação de cálcio dos ossos , cálculos renais devido ao aumento da excreção de cálcio na urina , calcificação dos vasos sanguíneos devido à deposição de cálcio e fosfato e um grande número deles ainda, sintomas parcialmente inespecíficos. Como o cálcio sérico é frequentemente determinado como parte de um exame de sangue de rotina , o diagnóstico geralmente é feito em um estágio inicial, quando não há sintomas ou apenas sintomas inespecíficos.
O hiperparatireoidismo primário é tratado pela remoção cirúrgica do adenoma da paratireoide. Se uma operação não for possível ou se não for desejada, o curso da doença pode ser observado por meio de verificações regulares do hormônio da paratireóide e do cálcio, se o cálcio sérico estiver ligeiramente aumentado. Se o cálcio estiver muito alto, a formação do hormônio da paratireóide pode ser inibida pelo medicamento Cinacalcet .
O hiperparatireoidismo secundário é tratado com vitamina D , cinacalcet e quelantes de fosfato , o último diminuindo os níveis aumentados de fosfato na doença renal crônica.
O hiperparatireoidismo terciário é tratado pela remoção cirúrgica das glândulas paratireoides. Para garantir a produção adequada de hormônio da paratireóide, qualquer parte de um corpo epitelial é deixada no lugar (paratireoidectomia subtotal) ou parte de um corpo epitelial é implantada em um músculo em outro lugar (retransplante autólogo).
As glândulas paratireoides (células epiteliais)
Os corpos epiteliais têm aproximadamente o tamanho de uma lente. Eles têm um diâmetro de 5 a 8 mm e um peso de cerca de 20 a 50 mg. Eles geralmente estão localizados na parte posterior dos pólos superior e inferior da glândula tireoide . No entanto, as glândulas paratireoides raramente podem ser encontradas na área do tórax. A razão pode ser encontrada no desenvolvimento embriológico das glândulas paratireoides. A maioria das pessoas possui quatro células epiteliais. Eles produzem o hormônio da paratireóide , um hormônio que regula o nível de cálcio no corpo.
Hormônio da paratireóide e equilíbrio de cálcio
O hormônio da paratireóide e o calcitriol são os dois principais hormônios que regulam o equilíbrio do cálcio-fosfato. A hormona paratiroideia mantém o soro nível de cálcio em uma faixa estreita, a curto prazo, aumentando a reabsorção de cálcio no sistema de túbulo dos rins e na promoção da libertação de cálcio através da repartição de substância óssea . Em longo prazo, o hormônio da paratireóide promove a conversão de calcidiol em calcitriol e, portanto, estimula a absorção de cálcio no intestino .
A secreção da hormona paratiroideia é pelo receptor sensível ao cálcio regulado que na superfície de paratiróide - células expressas é. Um aumento na concentração de cálcio ionizado leva, por meio da ativação do receptor sensível ao cálcio, a uma inibição da secreção do hormônio da paratireoide; uma diminuição no cálcio ionizado leva a um aumento da secreção do hormônio da paratireoide.
Hiperparatireoidismo primário
Patogênese
Em pacientes com hiperparatireoidismo primário, a secreção do hormônio da paratireóide é inadequadamente elevada em relação à concentração de cálcio no soro, desencadeada por um adenoma , adenocarcinoma ou hiperplasia de uma ou mais glândulas paratireoides (células epiteliais). A causa da secreção aumentada do hormônio da paratireoide é uma sensibilidade reduzida (sensibilidade) do receptor sensível ao cálcio devido a um número reduzido de receptores sensíveis ao cálcio por célula da paratireoide e / ou um aumento da massa de tecido da paratireoide devido a um número aumentado de paratireoide células. A regulação da secreção do hormônio da paratireoide não é completamente abolida, mas uma concentração mais alta de cálcio é necessária para inibir a secreção do hormônio da paratireoide - o valor alvo da concentração de cálcio é alterado para faixas mais altas.
etiologia
Apenas em casos raros pode ser encontrada uma causa de hiperparatiroidismo primário, radiação ionizante ou alterações genéticas .
Radiação ionizante
Um aumento da incidência de hiperparatireoidismo primário foi encontrado após a irradiação da região do pescoço; o risco de desenvolver hiperparatireoidismo primário aumenta com a dose de radiação . Houve também um aumento na incidência de hiperparatireoidismo primário em sobreviventes do bombardeio atômico em Hiroshima . Em pacientes com hiperparatireoidismo induzido por radiação, a incidência de câncer de tireoide é aumentada, mas por outro lado o curso não difere daquele de pacientes com hiperparatireoidismo idiopático (ou seja, hiperparatireoidismo sem causa demonstrável). Os dados sobre a ocorrência de hiperparatiroidismo primário após a terapia com radioiodo são contraditórios, um estudo encontrou um aumento da ocorrência, noutro estudo não foi possível confirmar uma ligação entre a terapia com radioiodo e hiperparatiroidismo.
Um estudo recente observou que os liquidatários que estavam ocupados descontaminando o reator nuclear de Chernobyl em 1986 tinham um risco significativamente aumentado de desenvolver hiperparatireoidismo primário.
Mudanças genéticas
No hiperparatireoidismo primário, geralmente há uma proliferação monoclonal de células da paratireoide atípicas, i. H. as células alteradas voltam a uma única célula-mãe alterada. No tecido alterado da paratireóide, mutações foram detectadas em toda uma série de genes : em genes que controlam o crescimento celular , em proto-oncogenes e em genes supressores de tumor .
Até agora, as mudanças nos seguintes genes foram descritas em detalhes:
- CYCLIN D1 tem múltiplas funções no crescimento celular , diferenciação celular e metabolismo celular . Um aumento da atividade da ciclina D1 desempenha um papel importante no desenvolvimento de tumores, incluindo adenomas da glândula paratireóide.
- Neoplasia endócrina múltipla tipo I; MEN1 : mutações inativadoras em MEN1, um gene supressor de tumor, levam a neoplasias hereditárias autossômicas dominantes das glândulas paratireoides , glândula pituitária e células das ilhotas no pâncreas , bem como um aumento da incidência de úlceras estomacais .
- HRPT2 codifica para a proteína Parafibromina , que em um complexo com outras proteínas ( PAF1 e CTR9 ) da RNA polimerase II e histona - metiltransferase se liga. Mutações em HRPT2 levar a adenoma da glândula paratiróide em conjunto com mandíbula - tumores , bem como carcinoma da paratiróide .
- Códigos RET para um receptor tirosina quinase . As mutações levam, entre outras coisas, à neoplasia endócrina múltipla do tipo IIA . Os pacientes afetados desenvolvem carcinomas de células C da glândula tireóide , feocromocitomas e, em 15 a 20% dos pacientes, hiperparatireoidismo primário.
clínica
O aumento do nível de hormônio da paratireóide leva a um aumento da perda óssea e, portanto, a um aumento da concentração de cálcio no sangue . O osso é desmineralizado. Pode ocorrer dor óssea. Nos rins, o hormônio da paratireóide garante uma redução da excreção de cálcio na urina, de modo que a quantidade de cálcio no sangue também aumenta. O produto de solubilidade pode ser excedido devido à reabsorção do cálcio da urina. Como resultado, desenvolvem-se cálculos renais . Além disso, ocorrem cálculos biliares e inflamação do pâncreas . Os sintomas de hiperparatireoidismo são descritos com as três palavras "dor de pedra, perna e estômago".
Hiperparatireoidismo secundário
A causa aqui é o aumento da produção de hormônio em resposta a uma maior perda de cálcio (deficiência de cálcio, hipocalcemia ) no corpo. Devido ao aumento compensatório da produção de hormônio, a concentração de cálcio no sangue pode estar na faixa normal inferior.
Doenças subjacentes do hiperparatireoidismo secundário:
- Insuficiência renal crônica (típica: nível de cálcio baixo, nível de fosfato muito alto)
- Síndrome de malassimilação: interrupção da absorção de cálcio no intestino.
- Cirrose hepática : conversão prejudicada de vitamina D 3 (colecalciferol) em 25-hidroxicolecalciferol no fígado. Devido à falta de vitamina D activa 3 , menos de cálcio é absorvida no intestino e menos de cálcio é reabsorvido nos rins.
- Colestase : Devido à falta de ácidos biliares , a absorção de vitamina D 3 a partir de alimentos é perturbado.
- Falta de exposição ao sol: A vitamina D 3 não pode mais ser formada na pele a partir do colesterol (ou 7-desidro-colesterol).
- raquitismo
Hiperparatireoidismo terciário
Se o hiperparatireoidismo secundário persistir por um longo período de tempo, não apenas a função das glândulas paratireoides é estimulada, mas também seu crescimento, de modo que, em última análise, pode ocorrer uma superprodução autônoma nas células epiteliais. Assim como no hiperparatireoidismo primário, a alça de controle é separada no local das glândulas paratireoides.
Hiperparatireoidismo quaternário e quinário
As formas quaternárias e quadráticas de hiperparatireoidismo são raras. O hiperparatireoidismo quaternário é um hiperparatireoidismo secundário baseado na lesão renal se a lesão renal em si foi causada por hiperparatireoidismo primário. Do ponto de vista fisiopatológico , a alça de controle é separada como no hiperparatireoidismo secundário no rim. Um hiperparatireoidismo é denominado quinário se a dissociação da secreção do hormônio da paratireóide de um ou mais corpos epiteliais remanescentes se baseia em um hiperparatireoidismo quaternário de longa data. No diagnóstico diferencial, a possibilidade de adenoma da paratireóide do sono deve ser considerada em ambas as situações.
Sintomas de hiperparatireoidismo
Ao diagnosticar hiperparatireoidismo primário, as seguintes manifestações da doença podem ocorrer:
- Aumento descoberto acidentalmente no nível de cálcio no sangue sem sinais clínicos de doença ( hipercalcemia assintomática ),
- Aumento dos níveis de cálcio no sangue com sinais clínicos ( hipercalcemia sintomática ),
- Doenças secundárias de hiperparatireoidismo: diminuição da densidade óssea (osteopenia) , perda óssea (osteoporose) , cálculos renais (nefrolitíase) ,
- raramente alterações ósseas típicas ( ostite fibrosa cística ) ou crise de hiperparatireoide.
Em anos anteriores, os sintomas clássicos da doença avançada geralmente estavam em primeiro plano quando apareceram: pedra - perna - dor de estômago devido a pedras nos rins , fraturas patológicas e úlceras gástricas . Desde o aumento nos exames de sangue e medidas de densidade óssea , predominam cursos sem sintomas (assintomáticos) e de baixo sintoma (oligossintomáticos) .
Para a desmineralização generalizada com tumores marrons em estágio avançado da doença, a denominação de síndrome de Engel-von Recklinghausen ou doença de Recklinghausen era usada anteriormente .
Hiperparatireoidismo assintomático
Pelo menos 80% de pacientes com hiperparatiroidismo primário ser o achado incidental de elevada soro - cálcio diagnosticada. A maioria desses pacientes tem hipercalcemia leve (média de 2,8 mmol / l, norma 2,1–2,6 mmol / l) e intermitente. Ocasionalmente, os níveis de cálcio são normais e o hiperparatireoidismo primário é diagnosticado devido à densidade óssea diminuída . Com uma história mais detalhada , alguns pacientes relatam sintomas inespecíficos, como perda de apetite (anorexia) , depressão leve, memória leve ou distúrbios neuromusculares .
No hiperparatireoidismo primário, geralmente há uma deficiência de vitamina D , que pode obscurecer o diagnóstico. Após a administração de vitamina D, o nível de cálcio pode então aumentar, o que indica o diagnóstico. A deficiência de vitamina D e o hiperparatireoidismo também podem levar a quadros clínicos mais pronunciados com adenomas de paratireoide maiores, concentrações maiores de hormônio da paratireoide, aumento da remodelação óssea e aumento de fraturas ósseas.
Hiperparatireoidismo sintomático
O cálcio é decomposto dos ossos devido ao aumento do nível do hormônio da paratireóide . A densidade óssea diminui, os níveis de cálcio no sangue e a excreção de cálcio na urina aumentam.
O aumento do nível de cálcio no sangue ( hipercalcemia ) leva a queixas inespecíficas, perda de apetite (anorexia) , náuseas (náuseas), prisão de ventre (constipação) , aumento da sede (polidipsia) e aumento da produção de urina (poliúria) .
Osteoporose e fraturas patológicas ocorrem nos ossos , especialmente na área da coluna vertebral .
Com hiperparatireoidismo renal secundário de longo prazo, os chamados tumores marrons, que consistem em células de degradação óssea (osteoclastos) e tecido conjuntivo , podem ocorrer nos ossos . O termo tumor marrom refere-se à cor marrom causada pelo sangramento.
Nos rins , o aumento da excreção de cálcio leva à precipitação de cálculos renais (nefrolitiais) , calcificações de tecidos moles (nefrocalcinose) , cólica renal , insuficiência renal crônica e distúrbios da função tubular . As pedras nos rins consistem principalmente de oxalato de cálcio , menos frequentemente de fosfato de cálcio . Cálculos renais estão presentes em cerca de 15–20% dos pacientes com hiperparatireoidismo primário, enquanto em cerca de 5% daqueles que têm cálculos renais, o hiperparatireoidismo primário é a causa da doença dos cálculos.
Os pacientes frequentemente se queixam de queixas neuromusculares , como fraqueza, exaustão e cansaço.
Além disso, os pacientes com hiperparatireoidismo primário são mais propensos a sofrer de doenças psiquiátricas do que na população normal, como indiferença (letargia) , depressão , perda de contato com a realidade (psicoses) , capacidade reduzida de interagir socialmente e habilidades cognitivas prejudicadas (demência ) . No entanto, os números exatos não estão disponíveis.
Há um aumento da prevalência de hipertensão , obesidade e tolerância à glicose diminuída , bem como doenças reumatológicas , como aumento do ácido úrico (hiperuricemia) , gota e pseudogota . Há evidências de que a prevalência de câncer é aumentada no hiperparatireoidismo primário e que o risco aumentado de câncer persiste mesmo após a remoção cirúrgica do adenoma da paratireoide. Com base nesses achados, fatores predisponentes comuns para hiperparatireoidismo e câncer são especulados.
Em pacientes com hiperparatireoidismo primário, há alta incidência de doenças cardiovasculares , principalmente hipertrofia ventricular esquerda e calcificações do músculo cardíaco (miocárdio) , valvas aórtica e mitral . O risco de morrer de doença cardíaca pode aumentar.
Mesmo com hiperparatireoidismo primário leve, os vasos sanguíneos enrijecem .
Em particular, o hiperparatireoidismo renal secundário pode levar à calcificação grave dos vasos , incluindo as artérias coronárias . As consequências são um aumento significativo da morbidade e mortalidade por doenças cardiovasculares .
A estreita conexão entre os ossos e as doenças cardiovasculares no hiperparatireoidismo secundário levou ao fato de que, nas últimas diretrizes, o termo osteopatia renal foi substituído pelo termo mineral renal e doença óssea (doença renal crônica - distúrbio mineral e ósseo), que inclui ambos metabolismo ósseo e distúrbio ósseo Calcificações vasculares e suas consequências.
Uma complicação particularmente grave de hyperparathylaxis secundária é ( calcifilaxia ), em que os depósitos de cálcio conduzem a trombose nas arteríolas da pele . Eles podem causar graves distúrbios circulatórios com extensa necrose da pele , que costumam ser fatais.
Além disso, a produção de gastrina é estimulada, de modo que pode levar a uma inflamação do revestimento do estômago (gastrite) e úlcera duodenal (ulcus duodeni) .
Epidemiologia
A incidência de hiperparatireoidismo primário diminuiu nos últimos anos. Em um registro americano, a incidência foi de 21,6 casos por 100.000 pessoas-ano de 1993 a 2001, 29,1 casos de 1983 a 1992 e 82,5 casos de 1974 a 1982. As razões para essa diminuição da frequência não é conhecido, as possíveis causas incluem a diminuição da exposição a radiação ionizante e melhoria do abastecimento de vitamina D .
O hiperparatireoidismo primário pode ocorrer em qualquer idade, mas a maioria das doenças não se manifesta antes dos 45 anos. As mulheres são afetadas cerca de duas vezes mais que os homens, possivelmente porque a perda óssea que ocorre após a menopausa pode desmascarar o hiperparatireoidismo latente .
histologia
Paratireóide
No hiperparatireoidismo primário, o exame do tecido das glândulas paratireoides descreve as seguintes alterações:
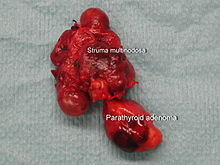
- Um único tumor benigno (adenoma) da glândula paratiróide é encontrada em 89% dos casos de hiperparatiroidismo primário, e dois adenomas são encontrados em cerca de 5% dos casos. A maioria dos adenomas é formada pelas células principais da paratireóide e é circundada por uma cápsula. Ocasionalmente, adenomas compostos por células oxifílicas são encontrados, esses adenomas geralmente são maiores. Também existem adenomas produtores de hormônio da paratireóide no timo .
- A hiperplasia glandular é encontrada em 6% dos casos . H. um aumento difuso de todos os quatro corpos da paratireóide devido à multiplicação das células principais. A hiperplasia glandular é muito raramente causada por um aumento das células claras.
- O carcinoma da paratireóide é encontrado em aproximadamente 2% dos casos e é caracterizado pela invasão da cápsula e dos vasos , linfonodos e metástases à distância .
osso
O exame histológico do osso revela alterações que são descritas como ostite fibrosa . O nível aumentado do hormônio da paratireóide ativa os osteoclastos . O aumento da atividade dos osteoclastos leva à degradação da substância óssea. O exame do tecido revela microfraturas e hemorragias. Formam-se cavidades que são preenchidas com tecido conjuntivo , osteoclastos e macrófagos carregados de hemossiderina . O aumento da dissolução (reabsorção) do tecido ósseo e da remodelação do tecido conjuntivo (fibrose) leva à formação de cistos ósseos que são visíveis a olho nu. Conforme a doença progride, os cistos ósseos se fundem para formar tumores marrons ; a cor marrom é o resultado de sangramento e depósitos de hemossiderina (estudos de caso e fig. Abaixo)
diagnóstico
Diagnóstico de hiperparatireoidismo primário
A primeira indicação de hiperparatireoidismo primário é um aumento do nível de cálcio ( hipercalcemia ). Outras causas de hipercalcemia podem ser diferenciadas pela determinação da concentração do hormônio da paratireóide . O diagnóstico de hiperparatireoidismo primário é feito quando o hormônio da paratireoide está aumentado ou quando o hormônio da paratireoide está na faixa normal de 10 a 60 pg / ml, mas está relativamente aumentado, com base em um nível de cálcio simultaneamente aumentado. Cerca de 80–90% dos pacientes com hiperparatireoidismo primário têm um hormônio da paratireoide elevado, em 10–20% dos pacientes o hormônio da paratireoide está na faixa normal.
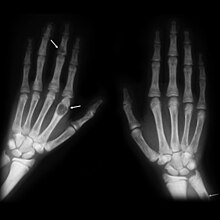
No hiperparatiroidismo primário, alterações osteolíticas na boca, mandíbula e área da face, em contraste com o resto do sistema esquelético, e. B. acro-osteólise , raramente observada, mas pode ser a primeira indicação clínica de distúrbio endócrino.
Diagnóstico diferencial de hiperparatireoidismo primário
Além do hiperparatireoidismo, os cânceres malignos são as causas mais comuns de hipercalcemia . Na maioria dos casos, quando ocorre hipercalcemia, o câncer é conhecido e progrediu. Além disso, os níveis de cálcio no câncer são mais elevados e os sintomas associados são mais graves. O hormônio da paratireóide é geralmente muito baixo na hipercalcemia devido ao câncer.
Outras causas de hipercalcemia, como síndrome do leite alcalino , sarcoidose e superdosagem de vitamina D, também podem ser diferenciadas do hiperparatireoidismo por redução do hormônio da paratireóide.
Na hipercalcemia hipocalzúrica familiar (HFH) , a excreção de cálcio na urina é reduzida; em pacientes com hiperparatireoidismo primário, por outro lado, a excreção de cálcio é normal ou aumentada.
Os diuréticos tiazídicos reduzem a excreção de cálcio pelos rins e conduzem a uma hipercalcemia ligeira. Em pacientes com hiperparatireoidismo leve, os diuréticos tiazídicos podem desmascarar a doença subjacente, causando um aumento significativo no cálcio sérico. Se um nível elevado de cálcio não cair após a descontinuação dos diuréticos tiazídicos, isso indica a presença de hiperparatireoidismo primário.
O lítio aumenta a secreção de hormônios da paratireoide e reduz a excreção de cálcio pelos rins, leva à hipercalcemia e hipocalzúria, alguns pacientes apresentam níveis aumentados de hormônio da paratireoide. A hipercalcemia pode normalizar após a descontinuação do lítio; após o tratamento prolongado com lítio (mais de 10 anos), a normalização do nível de cálcio após o final da terapia é menos provável.
Diagnóstico de hiperparatireoidismo secundário
O hiperparatireoidismo secundário é caracterizado por uma diminuição do nível de cálcio com um aumento adequado do hormônio da paratireoide.
A causa mais comum de hiperparatireoidismo secundário é uma produção reduzida de vitamina D ativada ( calcitriol ) devido ao comprometimento renal crônico .
Outras causas de hiperparatireoidismo secundário são:
- diminuição da ingestão de cálcio com alimentos
- diminuição da absorção de cálcio através do intestino ( má absorção de cálcio )
- fosfato aumentado ( hiperfosfatemia )
- Deficiência de vitamina D
- Cirurgia bariatrica
- Doença celíaca
- Insuficiência pancreática exócrina
- Perda de cálcio pelos rins
- Hipercalciúria idiopática
- Diuréticos de alça
- Redução da remodelação óssea, por ex. B. devido a bisfosfonatos
- Síndrome do osso com fome - síndrome do "osso com fome"
Diagnóstico diferencial de hiperparatireoidismo secundário
Alguns pacientes com hiperparatireoidismo primário apresentam cálcio sérico normal (hiperparatireoidismo primário normocalcêmico). Nesses casos, é difícil diferenciar entre hiperparatireoidismo primário e secundário. A diminuição da densidade óssea costuma ser a primeira manifestação da doença.
As causas do hiperparatireoidismo primário normoccalêmico são:
- Estágio inicial ou expressão incompleta (“forme fruste”) da doença; Ao longo de 3 anos, cerca de 40% das pessoas afetadas desenvolvem outras manifestações da doença (em metade dos casos, hipercalcemia, caso contrário, pedras nos rins, ossos quebrados, hipercalciúria, osteoporose). Portanto, verificações de acompanhamento são indicadas.
- Hiperparatireoidismo primário com deficiência simultânea de vitamina D
Química Clínica
O diagnóstico é feito por meio de exames laboratoriais .
- Um aumento do hormônio da paratireoide ou uma faixa normal alta indica hiperparatireoidismo primário com um aumento simultâneo do cálcio sérico .
- A excreção de cálcio na coleta de urina de 24 horas está aumentada em aproximadamente 40% dos pacientes com hiperparatireoidismo primário e normal em aproximadamente 60%. Se a excreção de cálcio exceder 400 mg / 24 h, o risco de cálculos renais aumenta. Uma redução da excreção de cálcio é encontrada na hipercalcemia hipocalzúrica familiar ou no hiperparatireoidismo primário com deficiência simultânea de vitamina D.
- Devido a um nível sanguíneo reduzido de 25 (OH) vitamina D3 , o hiperparatireoidismo primário com uma deficiência simultânea de vitamina D pode ser diferenciado da hipercalcemia hipocalzúrica familiar.
- No hiperparatireoidismo primário, os níveis séricos de calcitriol estão na faixa altamente normal ou estão aumentados; no hiperparatireoidismo secundário devido à insuficiência renal crônica, os níveis de calcitriol são reduzidos.
- No hiperparatireoidismo primário, a excreção de fosfato via rins é aumentada, o nível de fosfato no soro é reduzido ( hipofosfatemia ) ou está na faixa normal baixa. No hiperparatireoidismo renal secundário , o nível de fosfato está tipicamente aumentado.
- O aumento da creatinina sérica indica função renal prejudicada . Isso pode ser o resultado da hipercalcemia no hiperparatireoidismo primário, mas também pode ser a causa do hiperparatireoidismo secundário.
- Os marcadores bioquímicos da renovação óssea (por exemplo, fosfatase alcalina ) estão na faixa altamente normal ou elevada no hiperparatireoidismo primário e secundário.
Osteodensitometria
Em pacientes com hiperparatireoidismo primário, o conteúdo de sal mineral do osso é reduzido. A medida da densidade óssea ( densitometria óssea ) não é necessária para o diagnóstico, mas sim para avaliar a gravidade da doença para monitorar o progresso e determinar se o tratamento conservador ou cirúrgico está indicado.
Não há relação estreita entre fraturas e densidade óssea em pacientes com hiperparatireoidismo renal secundário. De acordo com o estado atual de conhecimento, a medição de densidade óssea de rotina não é útil no hiperparatireoidismo renal.
Diagnóstico de localização
Antes de uma operação planejada, a localização e o tamanho dos corpos da paratireoide afetados podem ser visualizados por ultrassonografia , cintilografia com tecnécio -99m- sestamibi , tomografia computadorizada ou ressonância magnética .
Terapia de hiperparatireoidismo
Terapia de hiperparatireoidismo primário
Terapia Cirúrgica
A remoção cirúrgica de (ou todos) os corpos epiteliais aumentados leva a uma melhoria na densidade óssea e na qualidade de vida , bem como a uma redução nas fraturas ósseas , em particular nas fraturas do colo do fêmur , em comparação com o monitoramento da progressão . Na maioria dos pacientes assintomáticos, entretanto, não há evidências de progressão da doença, como diminuição da densidade óssea, aumento do cálcio e do hormônio da paratireóide ou ocorrência de cálculos renais, mesmo após seguimento prolongado.
Por esse motivo, foram desenvolvidas diretrizes com o objetivo de encaminhar os pacientes para terapia cirúrgica com maior risco de lesão orgânica ou progressão da doença.
Critérios do Workshop NIH de 2002 sobre Hiperparatireoidismo Primário Assintomático para Terapia Cirúrgica:
- Cálcio sérico 0,25 mmol / l (1,0 mg / dl) acima do limite superior do normal.
- Excreção de cálcio na urina acima de 10 mmol / dia (400 mg / dia) com uma dieta normal.
- Depuração de creatinina 30% da idade média ou menos.
- Densidade óssea no quadril, coluna lombar ou rádio mais de 2,5 desvios padrão abaixo da média (valor T <-2,5).
- Idade inferior a 50 anos.
- Acompanhamento regular não é garantido.
Terapia não cirúrgica
Embora a terapia cirúrgica leve à cura definitiva do hiperparatireoidismo primário, nem todos os pacientes são operados, principalmente se não houver sintomas, apenas um ligeiro aumento do cálcio, se tiverem mais de 50 anos, se apresentarem comorbidades graves ou se uma operação não é desejada. Nestes casos, os seguintes procedimentos não cirúrgicos estão disponíveis:
- Os bisfosfonatos inibem a degradação do osso pelos osteoclastos . O alendronato leva a um aumento da massa óssea no hiperparatireoidismo primário assintomático. O risedronato reduz os níveis elevados de cálcio.
- O raloxifeno é um modulador seletivo do receptor de estrogênio . O raloxifeno reduz o cálcio sérico em mulheres na pós-menopausa com hiperparatireoidismo primário. Após cuidadosa avaliação de risco-benefício, uma terapia alternativa de reposição de estrogênio pode ser considerada.
- Os calcimiméticos (por exemplo, cinacalcet ) estão disponíveis desde 2004 , os quais atacam o receptor sensível ao cálcio da célula da paratireoide e, portanto, inibem diretamente a excreção dos hormônios da paratireoide.
- Ablação percutânea de álcool: a injeção de álcool no corpo da paratireóide dilatado pode destruí-lo. Os efeitos colaterais são danos ao nervo laríngeo recorrente e uma queda excessiva do cálcio sérico ( hipocalcemia )
- Além disso, uma dieta pobre em cálcio com conteúdo suficiente de vitamina D e atividade física regular são recomendados
Em pacientes não operados, o cálcio é verificado a cada seis meses, a creatinina e a densidade óssea verificados anualmente. Se houver algum indício de que a doença está progredindo, é realizada uma operação.
Terapia de hiperparatireoidismo secundário
O hiperparatireoidismo secundário geralmente é tratado eliminando a doença subjacente. Para hiperparatireoidismo secundário como resultado de insuficiência renal crônica, há uma terapia medicamentosa graduada estabelecida por diretrizes.
Hiperparatireoidismo secundário na insuficiência renal crônica
O hiperparatireoidismo secundário na insuficiência renal crônica é tratado com uma dieta pobre em fosfato, metabólitos da vitamina D, quelantes de fosfato e cinacalcet.
Se o nível de hormônio da paratireóide no estágio 2-3 da insuficiência renal crônica estiver acima de 70 pg / ml (ou> 110 pg / ml no estágio 4 ou> 300 pg / ml no estágio 5), uma dieta com baixo teor de fosfato é iniciada. Se uma dieta de baixo fosfato incapaz de reduzir o nível de fosfato suficientemente, as drogas são usadas que se ligam ao fosfato fornecido com alimentos no intestino (aglutinantes de fosfato orais): carbonato de cálcio , acetato de cálcio , hidróxido de alumínio , o sevelamer ou o carbonato de lantânio . Os aglutinantes de fosfato contendo cálcio não são usados no caso de aumento dos valores de cálcio devido ao risco de calcificação dos tecidos moles; a quantidade é limitada a 2,5 g de cálcio por dia. Os aglutinantes de fosfato contendo alumínio são usados apenas em níveis muito elevados de fosfato e por um período limitado de tempo devido ao risco de o alumínio se depositar nos ossos e no cérebro.
Um nível reduzido de vitamina D no soro, (25 (OH) vitamina D 3 <30 ng / ml) é compensado pela administração de vitamina D. Se o nível de hormônio da paratireóide não cair dentro da faixa-alvo, apesar dessas medidas, vitamina D ativa ( alfacalcidol ou calcitriol ) também é administrada. Um efeito colateral da terapia com vitamina D ativa é um aumento nos níveis de cálcio e fosfato com o risco de calcificação dos tecidos moles. Este efeito colateral é menor quando se usa metabólitos de vitamina D modificados farmacologicamente, como o paricalcitol .
Se uma dieta pobre em fosfato, ligantes de fosfato e metabólitos da vitamina D não tiverem sucesso, cinacalcet , um antagonista do receptor sensível ao cálcio, é usado.
Sem terapia, é provável uma transição para hiperparatireoidismo terciário.
Terapia do hiperparatireoidismo terciário
Se o nível do hormônio da paratireóide aumentar para valores acima de 1000 pg / ml, apesar da terapia com drogas e alterações ósseas e hipercalcemia refratária à terapia e / ou hiperfosfatemia ocorrer , todas as 4 (a 8) células epiteliais devem ser removidas ( paratireoidectomia ) e, em seguida, parte de um corpo epitelial deve ser transplantado para o antebraço ou o músculo esternocleidomastóideo , caso contrário, não haverá mais formação de hormônio da paratireóide . Alternativamente, uma paratireoidectomia subtotal pode ser realizada. H. um corpo de paratireóide não é completamente removido.
Veja também
Diretrizes
- John P. Bilezikian et al.: Declaração Resumida de um Workshop sobre Hiperparatireoidismo Primário Assintomático: Uma Perspectiva para o Século XXI . Em: J Clin Endocrinol Metab . Não. 12 , 2002, p. 5353-5361 ( Artigo ).
- Diretrizes de Prática Clínica KDOQI para Metabolismo Ósseo e Doença na Doença Renal Crônica ( Memento de 14 de fevereiro de 2015 no Arquivo da Internet ).
literatura
- Ludwig Weissbecker : Hiperparatireoidismo (Ostitis fibrosa generalisata, doença de Recklinghausen). In: Ludwig Heilmeyer (Hrsg.): Livro didático de medicina interna. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2ª edição, ibid. 1961, páginas 1057-1060.
Links da web
- Hiperparatiroidismo Patologia - Pathopic imagem banco de dados de da Universidade de Basel ( PathoPic instruções (PDF, 2.2 MB))
Evidência individual
- ↑ EM Brown: modelo de quatro parâmetros da relação sigmoidal entre a liberação do hormônio da paratireóide e a concentração extracelular de cálcio no tecido da paratireóide normal e anormal . In: The Journal of Clinical Endocrinology and Metabolism . fita 56 , não. 3 , março de 1983, ISSN 0021-972X , p. 572-581 , PMID 6822654 .
- ^ JH Brossard, S. Whittom, R. Lepage, P. D'Amour: Fragmentos carboxil-terminais do hormônio da paratireóide não são secretados preferencialmente no hiperparatireoidismo primário como são em outras condições hipercalcêmicas . In: The Journal of Clinical Endocrinology and Metabolism . fita 77 , não. 2 , agosto de 1993, ISSN 0021-972X , p. 413-419 , PMID 8345045 .
- ↑ LE Tisell, S. Carlsson, M. Fjälling, G. Hansson, S. Lindberg, LM Lundberg, A. Odén: hyperparathyroidism Subsequent to neck irradiation. Fatores de risco . In: Cancer . fita 56 , não. 7 , 1 de outubro de 1985, ISSN 0008-543X , pp. 1529-1533 , PMID 4027889 .
- ↑ AB Schneider, TC Gierlowski, E. Shore Freedman, M. Stovall, E. Ron, J. Lubin: relações dose-resposta para hiperparatiroidismo induzido por radiação . In: The Journal of Clinical Endocrinology and Metabolism . fita 80 , não. 1 , janeiro de 1995, ISSN 0021-972X , p. 254-257 , PMID 7829622 .
- ↑ S. Fujiwara, R. Sposto, H. Ezaki, S. Akiba, K. Neriishi, K. Kodama, Y. Hosoda, K. Shimaoka: Hiperparatireoidismo entre sobreviventes da bomba atômica em Hiroshima . In: Radiation Research . fita 130 , não. 3 , junho de 1992, ISSN 0033-7587 , pp. 372-378 , PMID 1594765 .
- ↑ S. Tezelman, JM Rodriguez, W. Shen, AE Siperstein, QY Duh, OH Clark: Hiperparatireoidismo primário em pacientes que receberam radioterapia e em pacientes que não receberam radioterapia . In: Journal ofthe American College of Surgeons . fita 180 , não. 1 de janeiro de 1995, ISSN 1072-7515 , pp. 81-87 , PMID 8000660 .
- ↑ Shanthi M Colaço, Ming Si, Emily Reiff, Orlo H Clark: Hiperparatireoidismo após terapia com iodo radioativo . In: American Journal of Surgery . fita 194 , no. 3 , setembro de 2007, ISSN 0002-9610 , p. 323-327 , doi : 10.1016 / j.amjsurg.2007.04.005 , PMID 17693276 .
- ↑ M. Fjälling, A. Dackenberg, I. Hedman, LE Tisell: Uma avaliação do risco de desenvolver hiperparatireoidismo após tratamento com 131I para tireotoxicose . In: Acta Chirurgica Scandinavica . fita 149 , não. 7 , 1983, ISSN 0001-5482 , pp. 681-686 , PMID 6650083 .
- ^ Bernhard O. Boehm, Silke Rosinger, David Belyi, Johannes W. Dietrich: A paratireóide como um alvo para danos por radiação . In: New England Journal of Medicine . fita 365 , não. 7 , agosto de 2011, p. 676-678 , doi : 10.1056 / NEJMc1104982 , PMID 21848480 .
- ^ S. Yavuz, WF Simonds, LS Weinstein, MT Collins, E. Kebebew, N. Nilubol, GQ Phan, SK Libutti, AT Remaley, M. Van Deventer, SJ Marx: Tumor de paratireóide adormecido: hiperfunção rápida após a remoção do dominante tumor. Em: J Clin Endocrinol Metab. 97 (6), junho de 2012, pp. 1834-1841, doi: 10.1210 / jc.2011-3030 , Epub 16 de abril de 2012. PMID 22508712
- ^ A b John P Bilezikian, John T Potts: Hiperparatireoidismo primário assintomático: novas edições e novas perguntas-construindo uma ponte sobre o passado com o futuro . In: Journal of Bone and Mineral Research . 17 Suplemento 2, novembro de 2002, ISSN 0884-0431 , p. N57-N67 , PMID 12412779 .
- ↑ Quem deu o nome
- ^ A b S. J. Silverberg, JP Bilezikian: Avaliação e gestão do hiperparatireoidismo primário . In: The Journal of Clinical Endocrinology and Metabolism . fita 81 , nº 6 , junho de 1996, ISSN 0021-972X , p. 2036-2040 , PMID 8964825 .
- ↑ Yuko Chiba, Katsuhiko Satoh, Satoshi Ueda, Nobuo Kanazawa, Yoshiaki Tamura, Toshiyuki Horiuchi: melhora acentuada dos sintomas psiquiátricos após paratireoidectomia em idosos com hiperparatireoidismo primário . In: Endocrine Journal . fita 54 , não. 3 , junho de 2007, ISSN 0918-8959 , p. 379-383 , doi : 10.1507 / endocrj.K06-152 , PMID 17420608 .
- ^ E. Lundgren, E. Szabo, S. Ljunghall, R. Bergström, L. Holmberg, J. Rastad: Estudo de caso-controle baseado na população de licença médica em mulheres pós-menopáusicas antes do diagnóstico de hiperparatireoidismo . In: BMJ (Clinical Research Ed.) . fita 317 , no. 7162 , 26 de setembro de 1998, ISSN 0959-8138 , p. 848-851 , PMID 9748176 , PMC 31094 (texto completo gratuito).
- ↑ P. Boudou, F. Ibrahim, C. Cormier, E. Sarfati, JC Souberbielle: Uma incidência muito alta de baixa concentração de 25 hidroxivitamina D no soro em uma população francesa de pacientes com hiperparatireoidismo primário . In: Journal of Endocrinological Investigation . fita 29 , nº 6 , junho de 2006, ISSN 0391-4097 , p. 511-515 , PMID 16840828 .
- ^ SJ Silverberg, E. Shane, DW Dempster, JP Bilezikian: Os efeitos da insuficiência da vitamina D em pacientes com hiperparatireoidismo primário . In: The American Journal of Medicine . fita 107 , não. 6 , dezembro de 1999, ISSN 0002-9343 , p. 561-567 , PMID 10625024 .
- ^ Sundeep Khosla, Joseph Melton: Risco de fratura no hiperparatireoidismo primário . In: Journal of Bone and Mineral Research: The Official Journal ofthe American Society for Bone and Mineral Research . 17 Suplemento 2, novembro de 2002, ISSN 0884-0431 , p. N103-N107 , PMID 12412786 .
- ↑ Wanjun Ren et al .: Página do questionário Setembro de 2008: paraplegia progressiva em um paciente em hemodiálise de longo prazo. Tumor marrom comprimindo a coluna vertebral torácica . In: American Journal of Kidney Diseases . fita 52 , no. 3 , setembro de 2008, ISSN 1523-6838 , p. A37 - A39 , doi : 10.1053 / j.ajkd.2007.12.029 ( ajkd.org [acessado em 7 de novembro de 2008]).
- ↑ Jane M Suh et al.: Hiperparatireoidismo primário: há um aumento na prevalência de cálculos renais? In: AJR. American Journal of Roentgenology . fita 191 , no. 3 , setembro de 2008, ISSN 1546-3141 , p. 908-911 , doi : 10.2214 / AJR.07.3160 , PMID 18716127 .
- ^ E. Lundgren et al.: Estudo de caso-controle em sintomas e sinais de hiperparatireoidismo primário "assintomático" . In: Cirurgia . fita 124 , no. 6 , dezembro de 1998, ISSN 0039-6060 , p. 980-985; discussão 985-986 , PMID 9854572 .
- ^ Theresia Weber e outros: Efeito da paratireoidectomia na qualidade de vida e nos sintomas neuropsicológicos no hiperparatireoidismo primário . In: World Journal of Surgery . fita 31 , nº 6 , junho de 2007, ISSN 0364-2313 , p. 1202-1209 , doi : 10.1007 / s00268-007-9006-6 , PMID 17460812 .
- ^ L. Lind, S. Jacobsson, M. Palmér, H. Lithell, B. Wengle, S. Ljunghall: Fatores de risco cardiovascular em hiperparatireoidismo primário: um acompanhamento de 15 anos de casos operados e não operados . In: Journal of Internal Medicine . fita 230 , não. 1 , julho de 1991, ISSN 0954-6820 , p. 29-35 , PMID 2066709 .
- ↑ Mark J Bolland, Andrew B Gray, Greg D Gamble, Ian R Reid: Associação entre hiperparatireoidismo primário e aumento do peso corporal: uma meta-análise . In: The Journal of Clinical Endocrinology and Metabolism . fita 90 , não. 3 , março de 2005, ISSN 0021-972X , p. 1525-1530 , doi : 10.1210 / jc.2004-1891 , PMID 15613408 .
- ↑ M. Procopio, G. Magro, F. Cesario, A. Piovesan, A. Pia, N. Molineri, G. Borretta: O teste de tolerância à glicose oral revela uma alta frequência de tolerância à glicose diminuída e diabetes mellitus tipo 2 não diagnosticado em hiperparatireoidismo primário . In: Diabetic Medicine: A Journal of the British Diabetic Association . fita 19 , não. 11 , novembro de 2002, ISSN 0742-3071 , p. 958-961 , PMID 12421435 .
- ↑ Mishaela R Rubin, Shonni J Silverberg: manifestações reumáticas de hiperparatireoidismo primário e terapia com hormônio da paratireóide . In: Relatórios atuais de reumatologia . fita 4 , não. 2 , abril de 2002, ISSN 1523-3774 , p. 179-185 , PMID 11890884 .
- ↑ M. Palmér HO Adami, UB Krusemo, S. Ljunghall: Aumento do risco de doenças malignas após a cirurgia de hiperparatireoidismo primário. Um estudo de coorte nacional . In: American Journal of Epidemiology . fita 127 , no. 5 , maio de 1988, ISSN 0002-9262 , pp. 1031-1040 , PMID 3358404 .
- ^ Inga-Lena Nilsson, Jan Zedenius, Li Yin, Anders Ekbom: A associação entre hiperparatireoidismo primário e malignidade: análise de coorte nacional na incidência de câncer após a paratireoidectomia . In: Endocrine-Related Cancer . fita 14 , não. 1 , março de 2007, ISSN 1351-0088 , p. 135-140 , doi : 10.1677 / erc.1.01261 , PMID 17395982 .
- ↑ Karin B Michels, Fei Xue, Lena Brandt, Anders Ekbom: Hiperparatireoidismo e subsequente incidência de câncer de mama . In: International Journal of Cancer . fita 110 , não. 3 , 20 de junho de 2004, ISSN 0020-7136 , p. 449-451 , PMID 15095313 .
- ↑ T. Stefenelli et al.: Anormalidades cardíacas em pacientes com hiperparatireoidismo primário: implicações para o acompanhamento . In: The Journal of Clinical Endocrinology and Metabolism . fita 82 , não. 1 , janeiro de 1997, ISSN 0021-972X , p. 106-112 , PMID 8989242 .
- ↑ Patrik Andersson, Erik Rydberg, Ronnie Willenheimer: Hiperparatireoidismo primário e doença cardíaca - uma revisão . In: European Heart Journal . fita 25 , não. 20 de outubro de 2004, ISSN 0195-668X , p. 1776–1787 , doi : 10.1016 / y.ehj 2004.07.010 , PMID 15474692 .
- ^ JC Smith e outros: Aumento da pressão arterial central no hiperparatireoidismo primário leve . In: The Journal of Clinical Endocrinology and Metabolism . fita 85 , não. 10 de outubro de 2000, ISSN 0021-972X , p. 3515-3519 , PMID 11061493 .
- ↑ Mishaela R Rubin et al .: Rigidez arterial em hiperparatireoidismo primário leve . In: The Journal of Clinical Endocrinology and Metabolism . fita 90 , não. 6 , junho de 2005, ISSN 0021-972X , p. 3326-3330 , doi : 10.1210 / jc.2004-1400 , PMID 15769995 .
- ^ Giorgio Coen: Calcimiméticos, hormônio da paratireóide e calcificação vascular na doença renal crônica . In: Kidney International . fita 74 , não. 10 de novembro de 2008, ISSN 1523-1755 , pp. 1229-1231 , doi : 10.1038 / ki.2008.417 , PMID 18974757 .
- ↑ Goce B. Spasovski: Saúde óssea e relações de calcificação vascular na doença renal crônica . In: International Urology and Nephrology . fita 39 , no. 4 , 2007, ISSN 0301-1623 , p. 1209-1216 , doi : 10.1007 / s11255-007-9276-9 , PMID 17899431 .
- ↑ Hirotaka Komaba et al: Tratamento da doença renal crônica - distúrbio mineral e ósseo (CKD-MBD) . In: Medicina Interna (Tóquio, Japão) . fita 47 , no. 11 , 2008, ISSN 1349-7235 , p. 989-994 , doi : 10.2169 / internalmedicine.47.1051 , PMID 18520108 .
- ↑ MD Arenas et al.: Tratamento da arteriolopatia urêmica calcificada (calcifilaxia) com uma combinação de tratamentos, incluindo oxigenoterapia hiperbárica . In: Clinical Nephrology . fita 70 , não. 3 , setembro de 2008, ISSN 0301-0430 , p. 261-264 , PMID 18793571 .
- ↑ Hiroshi Sato et al .: Hiperparatireoidismo primário com úlcera duodenal e infecção por H. pylori . In: Medicina Interna (Tóquio, Japão) . fita 41 , no. 5 , maio de 2002, ISSN 0918-2918 , p. 377-380 , PMID 12058887 .
- ^ RA Wermers e outros: Incidência de hiperparatireoidismo primário em Rochester, Minnesota, 1993-2001: uma atualização na epidemiologia em mudança da doença . In: J Bone Miner Res. Band 21 , não. 1 , 2006, p. 171-177 , doi : 10.1359 / JBMR.050910 , PMID 16355286 .
- ↑ GI Salti, I. Fedorak, T. Yashiro, N. Fulton, H. Hara, D. Yousefzadeh, EL Kaplan: Continuação da evolução no tratamento cirúrgico do hiperparatireoidismo primário . In: Archives of Surgery . fita 127 , no. 7 , julho de 1992, ISSN 0004-0010 , pp. 831-836; discussão 836-837 , PMID 1524484 .
- ↑ D. Bartsch, C. Nies, C. Hasse, J. Willuhn, M. Rothmund: Aspectos clínicos e cirúrgicos do adenoma duplo em pacientes com hiperparatiroidismo primário . In: British Journal of Surgery . fita 82 , não. 7 , julho de 1995, ISSN 0007-1323 , pp. 926-929 , PMID 7648110 .
- ↑ Alexander Maret, Isabelle Bourdeau, Changlin Ding, Shrihari S Kadkol, William H Westra, Michael A Levine: A expressão de GCMB por adenomas secretores de hormônio da paratireóide intratímico indica sua origem na célula da paratireóide . In: The Journal of Clinical Endocrinology and Metabolism . fita 89 , não. 1 , janeiro de 2004, ISSN 0021-972X , p. 8-12 , PMID 14715818 .
- ↑ James M Ruda, Christopher S Hollenbeak, Brendan C Stack: Uma revisão sistemática do diagnóstico e tratamento do hiperparatireoidismo primário de 1995 a 2003 . In: Otorrinolaringologia - Cirurgia de Cabeça e Pescoço . fita 132 , no. 3 , março de 2005, ISSN 0194-5998 , p. 359-372 , doi : 10.1016 / j.otohns.2004.10.005 , PMID 15746845 .
- ↑ AG Wynne, J. van Heerden, JA Carney, LA Fitzpatrick: Carcinoma de paratireóide: características clínicas e patológicas em 43 pacientes . In: Medicine . fita 71 , no. 4 , julho de 1992, ISSN 0025-7974 , pp. 197-205 , PMID 1518393 .
- ↑ Wanjun Ren, Xiaoping Wang, Bin Zhu, Zidong Liu: Página do questionário Setembro de 2008: paraplegia progressiva em um paciente de hemodiálise de longo prazo. Tumor marrom comprimindo a coluna vertebral torácica . In: American Journal of Kidney Diseases: The Official Journal of the National Kidney Foundation . fita 52 , no. 3 , setembro de 2008, ISSN 1523-6838 , p. A37 - A39 , doi : 10.1053 / j.ajkd.2007.12.029 ( ajkd.org [acessado em 7 de novembro de 2008]).
- ↑ George M. Nassar, Juan Carlos Ayus: Brown Tumor in End-Stage Renal Disease . In: N Engl J Med . fita 341 , no. 22 , 25 de novembro de 1999, pp. 1652 , doi : 10.1056 / NEJM199911253412204 .
- ^ AN Hollenberg, A. Arnold: Hipercalcemia com soro PTH intacto baixo-normal: uma apresentação nova do hiperparatireoidismo primário . In: Am J Med . fita 91 , no. 5 , novembro de 1991, pp. 547-548 , PMID 1951417 .
- ↑ SR Nussbaum et al.: Ensaio imunorradiométrico de dois locais de alta sensibilidade da paratirina e sua utilidade clínica na avaliação de pacientes com hipercalcemia . In: Clin Chem . fita 33 , não. 8 , agosto de 1987, p. 1364-1367 , PMID 3608153 ( clinchem.org ).
- ↑ W. Millesi, B. Niederle et al.: Osteólises na área da mandíbula como a primeira indicação de hiperparatiroidismo primário. In: Acta Chirurgica Austriaca. Volume 26, Edição 6, 1994, páginas 410-414. doi: 10.1007 / BF02620046
- ↑ gel H Fuleihan: Hipercalcemia hipocalciúrica benigna familiar . In: J Bone Miner Res . 17 Suplemento 2, 2002, p. 51-56 , PMID 12412778 .
- ↑ H. Lowe: Hiperparatireoidismo primário normocalcêmico: Caracterização adicional de um novo fenótipo clínico . Em: J Clin Endocrinol Metab . Não. 92 , 2007, p. 3001 , PMID 17536001 ( endojournals.org ).
- ↑ P. Ureña et al.: Densidade mineral óssea, marcadores bioquímicos e fraturas esqueléticas em pacientes em hemodiálise . In: Transplante de dial de nefrol . Não. 18 , 2003, p. 2325-2331 , PMID 14551361 ( oxfordjournals.org ).
- ^ SA Jamal e outros: Baixa densidade mineral óssea e fraturas em pacientes a longo prazo da hemodiálise: uma meta-análise . In: Am J Kidney Dis . fita 49 , no. 5 , maio de 2007, pp. 674-681 , PMID 17472850 .
- ↑ Elena Ambrogini et al: Cirurgia ou Vigilância para Hiperparatireoidismo Primário Assintomático Leve: Um Estudo Clínico Randomizado Prospectivo . Em: J Clin Endocrinol Metab . Não. 92 , 2007, p. 3114-3121 ( resumo ).
- ^ Lindi H. VanderWalde e outros: O efeito da paratireoidectomia no risco de fratura óssea em pacientes com hiperparatireoidismo primário . In: Arch Surg . Não. 141 , 2006, pp. 885-891 ( resumo ).
- ↑ John P. Bilezikian et al.: Declaração Resumida de um Workshop sobre Hiperparatireoidismo Primário Assintomático: Uma Perspectiva para o Século XXI . In: J. Clin. Endocrinol. Metab. Não. 12 , 2002, p. 5353-5361 ( Artigo ).
- ↑ B. Farford, RJ Presutti, TJ Moraghan: Nonsurgical Management of Primary hyperparathyroidism . In: Mayo Clin Proc . fita 82 , não. 3 , 2007, p. 351-355 .
- ↑ Eleanor Lederer, Rosemary Ouseph: Doença Renal Crônica . In: American Journal of Kidney Diseases . fita 49 , no. 1 , 2007, p. 162-171 ( Artigo ).
- ↑ K / DOQI: Diretrizes de Prática Clínica para Metabolismo Ósseo e Doença na Doença Renal Crônica - Diretriz 14 . In: American Journal of Kidney Diseases . 42, Suplemento 3, 2003, p. 1–202 ( Artigo ( Memento de 21 de fevereiro de 2013 no Arquivo da Internet )). Clinical Practice Guidelines para Metabolismo Ósseo e Doença de doença renal crônica - Orientação 14 ( Memento do originais datado 21 de fevereiro de 2013 na Internet Archive ) Informações: O arquivo de ligação foi inserido automaticamente e ainda não foi marcada. Verifique o link original e o arquivo de acordo com as instruções e, em seguida, remova este aviso.
- ↑ K / DOQI: Diretrizes de Prática Clínica para Metabolismo Ósseo e Doença na Doença Renal Crônica Diretriz 15 . In: American Journal of Kidney Diseases . fita 42 , Suplemento 3, outubro de 2003, p. 1–202 ( Artigo ( Memento de 20 de junho de 2012 no Arquivo da Internet )). Clinical Practice Guidelines para Metabolismo Ósseo e doenças em Doença Renal Crônica Recomendação 15 ( Memento do originais de 20 de junho de 2012 no Internet Archive ) Info: O arquivo de ligação foi inserido automaticamente e ainda não foi marcada. Verifique o link original e o arquivo de acordo com as instruções e, em seguida, remova este aviso.