Microscópio confocal

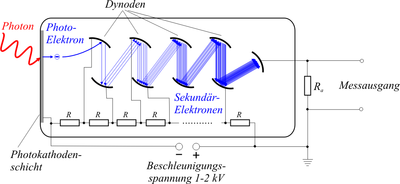
Um microscópio confocal (de confocal ou confocal , tendo o mesmo foco ) é um microscópio de luz especial . Em contraste com a microscopia de luz convencional, nem todo o espécime é iluminado, mas apenas uma fração dele em qualquer ponto no tempo, em muitos casos apenas um pequeno ponto de luz. Esta iluminação é rasterizada peça por peça sobre o espécime . Portanto, em nenhum momento uma imagem completa surge no microscópio. As intensidades de luz da luz reflectida ou luz emitida por fluorescência são, consequentemente, uma após a outraMedido em todos os locais da área a ser fotografada, de forma que uma construção subsequente da imagem seja possível. No caminho do feixe da luz detectada, há um orifício que permite que a luz da área fortemente focada passe e bloqueia a luz de outros planos. Como resultado, apenas a luz de um pequeno volume em torno do ponto focal chega ao detector, de modo que são geradas imagens seccionais ópticas com alto contraste , que quase só contêm luz de uma camada estreita em torno do respectivo plano focal .
Os microscópios confocais de hoje estão disponíveis em designs diferentes. São scanners pontuais generalizados, nos quais um feixe de laser focalizado varre a amostra ( microscópio confocal de varredura a laser , engl. Microscópio confocal de varredura a laser , CLSM e LSCM de acordo com a engl. Para fazer a varredura : rasterizar). Com os scanners de linha, por outro lado, uma linha inteira de imagens é criada de uma vez, para que uma velocidade maior seja alcançada. Uma terceira variante usa um disco de Nipkow no qual vários diafragmas perfurados estão dispostos em espiral. À medida que o disco gira , cada orifício faz a varredura de uma curva circular da amostra. Esta variante usa luz branca para iluminação de luz incidente, o que leva à reflexão na amostra. Ou a fluorescência é excitada, como também é possível com os outros tipos de construção. Então, eles fazem parte do microscópio de fluorescência .
Os primeiros microscópios confocais foram construídos em meados do século XX. No entanto, foi só na década de 1980 que novas possibilidades técnicas, incluindo lasers e sistemas de computador , permitiram novos desenvolvimentos que levaram a uma maior disseminação.
O princípio confocal
Uma fonte de luz pontual é capturada na amostra em um microscópio confocal. Do ponto iluminado dessa forma, a luz é focada através da lente em um orifício antes de chegar ao detector. O ponto no meio do orifício e o ponto de iluminação na amostra são confocais um ao outro, ou seja , eles estão em foco ao mesmo tempo.
A microscopia confocal pode, em princípio, ser realizada com luz transmitida ou com luz incidente . Os microscópios confocais de hoje são geralmente microscópios de luz refletida, eles usam a lente para iluminação e detecção. Em alguns tipos de edifícios, não há apenas um, mas vários pontos de iluminação que são projetados simultaneamente em diferentes pontos do espécime. Por uma questão de simplicidade, o princípio é explicado aqui usando o exemplo de um único ponto de iluminação que é gerado pela luz incidente.
Caminho do feixe da fonte de luz para o espécime
A luz proveniente da fonte de luz (verde no desenho esquemático) é primeiro focada no orifício de excitação para gerar uma fonte de luz pontual. Também no uso alemão, este e o segundo pinhole são freqüentemente referidos com a expressão inglesa pinhole (literalmente: agulha buraco). Em microscópios confocais de varredura a laser mais recentes, os lasers de iluminação são acoplados a fibras de vidro , e o orifício de excitação pode então ser substituído por estes, uma vez que o pequeno núcleo de fibra guia de luz tem propriedades opticamente restritivas semelhantes.
A iluminação é passada para um divisor de feixe . Com a microscopia de luz branca, é usado um espelho semitransparente que reflete uma proporção suficiente da luz na amostra. Se a fluorescência deve ser detectada na amostra, um espelho dicróico é usado que reflete a luz de excitação, mas deixa a luz fluorescente passar. Finalmente, uma imagem reduzida do orifício de excitação é projetada através da objetiva no espécime. Por causa da difração , um disco de difração (mais precisamente: uma função de espalhamento de ponto ) e não um ponto real é criado no ponto focal .
Caminho do feixe da amostra para o orifício de detecção
A luz a ser detectada emana do ponto iluminado na amostra (vermelho no desenho esquemático). Isso pode ser luz refletida ou fluorescência. A parte captada pela objetiva passa pelo divisor de feixe e é combinada novamente em um ponto (um disco de difração) no plano intermediário da imagem. No caso de objetivas modernas com um comprimento de tubo infinito , uma lente de tubo também é necessária para isso. O orifício de detecção é centralizado em torno deste ponto no plano intermediário da imagem. É tipicamente grande o suficiente para que sua borda atinja o primeiro mínimo do disco de difração. O diâmetro real, portanto, depende da abertura numérica e da ampliação da objetiva usada. Um outro aumento até o nível da placa de abertura também pode ser realizado a fim de aumentar o diâmetro do disco de difração e, portanto, o diâmetro da placa de abertura. Painéis maiores podem ser fabricados com mais facilidade.
Na maioria das amostras, a luz não é emitida apenas do ponto realmente iluminado na amostra, mas também das áreas acima ou abaixo (rosa no diagrama). Por exemplo, os corantes fluorescentes também são excitados em planos acima e abaixo do plano de foco. A luz proveniente desses pontos, entretanto, não é combinada em um ponto no plano intermediário da imagem, mas em planos na frente ou atrás dele, de modo que os raios de luz desses pontos estão presentes como cones de feixe no plano intermediário da imagem. A maioria desses cones de feixe são, portanto, bloqueados pelo diafragma perfurado, de modo que apenas muito pouca luz atinge o detector que não foi emitida do ponto focal na amostra.
A informação óptica que não vem do ponto focal da amostra é, portanto, suprimida duas vezes: Em primeiro lugar, não é "questionada" porque a intensidade de iluminação fora do foco é fraca e, em segundo lugar, a luz de fora do ponto focal é quase completamente bloqueada em o furo de alfinete. Isso resulta em uma melhora significativa no contraste e também em uma resolução um pouco melhor .
O chamado “ponto de foco”, a partir do qual a luz contribui para a criação da imagem, é um volume tridimensional. A forma exata deste volume é uma função de espalhamento de ponto ( função de espalhamento de ponto inglês, abreviado PSF), respectivamente. Quanto menor for o volume, melhor será a resolução do microscópio.
Uma vez que atinge apenas um pequeno volume da luz de preparação até o detector, é possível que a formação da imagem seja necessária para mover esse volume acima da amostra, portanto, faça a varredura da amostra. Mesmo se vários pontos de foco forem usados, eles devem ser movidos sobre a amostra. No próprio microscópio nunca se cria uma imagem completa do espécime, só então é gerada no computador ou, no caso de vários pontos, no filme ou no chip de uma câmera.
O microscópio confocal de varredura a laser - varredura com um feixe de laser focalizado

Na pesquisa biomédica, os microscópios confocais de varredura a laser (abreviatura CLSM, em inglês: confocal laser scan microscope , mais raramente LSCM, alemão também: laser scanning microscope ) são comuns, nos quais um feixe de laser focado pela lente varre um objeto ponto por ponto . Normalmente, a fluorescência é detectada por marcadores especiais; é então uma forma de microscopia de fluorescência de luz refletida . Lasers são usados porque não é possível concentrar luz suficiente de outras fontes de luz em um ponto para excitação de fluorescência intensiva. Esses dispositivos também podem ser usados para microscopia de reflexão confocal.
Os elementos ópticos adicionalmente necessários para a microscopia confocal são acomodados em dispositivos comerciais em uma caixa flangeada para um microscópio de alta qualidade. A luz do laser é direcionada para esta caixa do scanner e refletida de lá para o microscópio, a fim de alcançar a amostra através da objetiva. O sinal gerado na preparação vai no sentido inverso, voltando para a caixa, onde a intensidade do sinal é medida atrás do orifício. O processo de gravação é controlado por um computador e as imagens são exibidas no monitor do computador.
Do laser à preparação

Normalmente, esses dispositivos têm vários lasers de excitação, por exemplo, um laser de argônio que emite vários comprimentos de onda (458, 488, 514 nm e outros) e lasers de hélio-neon que emitem luz a 543 ou 633 nm. A luz de lasers de cores diferentes pode ser sobreposta com divisores de feixe dicróicos . Em muitos dispositivos atuais, a intensidade dos respectivos comprimentos de onda é modulada por meio de um modulador acústico-óptico (também: filtro sintonizável acústico-óptico , AOTF).
Em dispositivos mais novos, a luz do laser é frequentemente conduzida para a caixa do scanner por meio de fibras de vidro . Uma vez que o pequeno núcleo guia de luz de uma fibra de vidro é semelhante a um orifício de agulha, o orifício de excitação pode ser omitido. A luz agora incide sobre o divisor de feixe dicróico , que a direciona para o primeiro espelho de varredura. Ao usar vários comprimentos de onda de excitação, podem ser usados divisores de feixe duplo ou triplo, que refletem dois ou três comprimentos de onda em direção à preparação, mas permitem a passagem da respectiva luz fluorescente. Em alguns dispositivos, essa função é assumida por outro modulador acústico-óptico, que é então denominado divisor de feixe acústico-óptico (AOBS).
O movimento do espelho de varredura determina quão rápido e em qual área o ponto de excitação (mais precisamente: o volume de excitação limitado por difração) varre a amostra. A velocidade de varredura é dada em linhas de imagem por segundo, ou seja, em Hertz (Hz). As velocidades típicas estão entre 200 e 2000 Hz. O tamanho e a posição da área digitalizada são determinados pela deflexão precisamente controlada do espelho. O ponto de excitação é continuamente movido ao longo da preparação dentro de uma linha de imagem e o número de pontos de imagem ( pixels ) por linha é obtido pela definição do chamado tempo de permanência do pixel ( tempo de permanência do pixel , tempo até que o sinal seja atribuído ao próximo pixel ) Junto com o número de linhas da imagem, isso dá o número total de pontos da imagem, por exemplo 512 × 512 pixels. O controle variável dos espelhos de varredura, portanto, permite tirar fotos com diferentes ampliações com a mesma lente. Esta é uma diferença importante para os sistemas baseados em câmera.
Usando lentes e espelhos adicionais, a luz de excitação é finalmente guiada através da objetiva para a amostra, onde ocorre a excitação ou reflexão de fluorescência.
Da preparação ao detector

A luz fluorescente segue o mesmo caminho de volta através do espelho de varredura, passa pelo divisor de feixe dicróico e, de acordo com o princípio confocal descrito acima, atinge o orifício em um plano de imagem intermediário e finalmente para os detectores. Alternativamente ou adicionalmente, a luz refletida também pode ser capturada por meio desse caminho de feixe. Além da resolução da lente utilizada (mais precisamente: sua abertura numérica ) e do comprimento de onda da respectiva luz, o diâmetro do orifício determina a profundidade de campo e, portanto, a "espessura" da seção óptica. Se o diâmetro do orifício estiver no primeiro mínimo do disco de difração (1 unidade Airy), a maior parte da luz de outros planos é bloqueada e a maior parte do sinal real passa por ele. Se o diafragma é aberto mais, mais luz passa dos níveis de preparação superiores e inferiores, de modo que mais partes borradas contribuem para a imagem (veja as ilustrações). Se o obturador for mais fechado do que uma unidade Airy, haverá uma queda acentuada no brilho, o que também torna a imagem nítida mais difícil.
Para poder registrar várias cores fluorescentes ou luz refletida e fluorescente em paralelo confocalmente, a luz é espectralmente separada na frente do detector. Teoricamente, o tamanho do orifício de detecção teria que ser ajustado para cada comprimento de onda, uma vez que o diâmetro do disco de difração depende linearmente do comprimento de onda. Na verdade, em alguns dispositivos anteriores (por exemplo, no Zeiss LSM 410), a separação espectral acontecia primeiro e cada área de cor tinha seu próprio orifício. No entanto, por razões práticas, os dispositivos comerciais de hoje usam apenas um furo de agulha para todas as cores. A separação espectral ocorre apenas por trás disso, por exemplo, com divisores de feixe dicróicos que direcionam componentes de cores diferentes para detectores diferentes.

Fotomultiplicadores (PMTs) são normalmente usados como detectores em dispositivos comerciais e, às vezes, também fotodiodos de avalanche (APDs) são usados em aplicações especiais . Novos fotodetectores híbridos (HPDs) combinam propriedades de PMTs e APDs. Como muitos PMTs normais, eles são fabricados pela Hamamatsu Photonics e instalados por vários fornecedores de microscópio.
Alguns dispositivos possuem um detector adicional no caminho do feixe atrás do espécime, que coleta a luz do laser que o atravessa. No computador, uma espécie de imagem de campo claro pode ser reconstruída a partir dos valores medidos, em que as estruturas que absorvem ou defletem a luz na preparação são representadas por áreas escuras. No caminho para este detector, no entanto, a luz não passa por um orifício, de modo que nenhuma imagem confocal é criada.
Características especiais da gravação
Para aumentar a relação sinal-ruído e, consequentemente, a qualidade da imagem, o software de controle permite gravar uma imagem várias vezes e calcular o valor médio. Isso ajuda a reduzir a influência do ruído de Poisson dos fótons capturados e do ruído estatístico dos componentes eletrônicos na imagem, especialmente no caso de amostras fracamente fluorescentes , uma vez que o ruído é distribuído de forma diferente com cada exposição e, portanto, menos importante para múltiplos exposições.
Os microscópios confocais de varredura a laser comerciais atuais podem mudar o plano focal passo a passo, movendo a objetiva ou a amostra para gerar seções óticas seriais (veja a sequência do filme). Essa série de imagens pode ser usada como base para reconstruções tridimensionais de computador (ver figuras).
Método de varredura de ponto sem espelho de varredura
Os primeiros microscópios confocais tinham uma trajetória de feixe imóvel; em vez disso, o espécime foi movido, pois isso era tecnicamente mais fácil de conseguir (veja a história abaixo ). Embora essa abordagem de “varredura de palco” seja significativamente mais lenta devido à massa a ser movida, ela tem a vantagem de que a intensidade de iluminação é exatamente a mesma para todos os pontos da amostra. No caso de "varredura de feixe", ou seja, o movimento do feixe de laser sobre a amostra imóvel mostrada acima, a iluminação na borda do campo de visão é um pouco menos intensa. Para aplicações para as quais isso é importante e a alta velocidade não é necessária, a varredura de palco também pode ser usada hoje (a partir de 2013), por exemplo, espectroscopia de correlação de fluorescência (FCS). Com o FCS, a intensidade da fluorescência no volume detectado é medida por um longo período de tempo em um ponto, de modo que a confocalidade é absolutamente necessária, mas nenhum dispositivo de varredura é necessário.
Uma terceira opção para escanear um plano da amostra é mover a objetiva para os lados. Esta opção raramente é usada. O primeiro microscópio confocal a laser usou essa abordagem (veja abaixo ), mas os dispositivos comerciais atuais (2017) também estão disponíveis com essa opção.
Dispositivos comerciais
Os microscópios confocais de varredura a laser com varredura por feixe para as ciências da vida são oferecidos pelos quatro principais fabricantes de microscópio ( Carl Zeiss , Leica Microsystems , Nikon e Olympus ). Alguns desses dispositivos combinam a microscopia confocal com outras aplicações de microscopia de varredura a laser , como microscopia multifotônica ou microscopia STED . Bio-Rad , o primeiro fabricante de microscópios confocais de varredura a laser comerciais, entretanto, vendeu seu departamento de microscópios para a Zeiss, de modo que a marca não aparece mais no mercado de microscópios. Existem também vários fabricantes que oferecem microscópios confocais de varredura a laser para aplicações especiais. Isso inclui PicoQuant, HORIBA, ISS e WITec.
Aplicações especiais com microscópios confocais de varredura a laser
As propriedades especiais do microscópio confocal de varredura a laser permitem outras aplicações além da produção de seções ópticas. Em alguns casos, é necessário equipamento adicional para isso. Essas técnicas incluem recuperação de fluorescência após fotodegradação (FRAP), espectroscopia de correlação de fluorescência (FCS), espectroscopia de fluorescência de molécula única , transferência de energia de ressonância Förster (FRET), espectroscopia Raman e microscopia de fluorescência (FLIM).
Scanner de linha
Os scanners de ponto são relativamente lentos porque cada ponto da amostra deve ser examinado individualmente. Este não é apenas um problema técnico da velocidade máxima que pode ser alcançada: se os pontos individuais da imagem forem digitalizados muito rapidamente, não será capturada luz fluorescente suficiente para criar uma imagem com contraste suficiente . Uma maneira de contornar esse problema é iluminar o espécime com uma linha (em vez de um ponto) e guiar a luz fluorescente por uma fenda correspondente em vez de por um orifício. Isso resulta em uma resolução diferente ( anisotrópica ) nas direções xey. Na direção da linha de varredura e do diafragma de fenda (x), a resolução corresponde a um microscópio convencional, as vantagens do microscópio confocal só entram em jogo perpendicular a ele (direção y). Antes do desenvolvimento de microscópios de disco giratório adequados para microscopia de fluorescência, os scanners de linha eram de longe a maneira mais rápida de criar imagens confocais de espécimes fracamente fluorescentes.
A principal dificuldade técnica na construção e operação de scanners de linha é a realização de uma linha de excitação estreita limitada por difração com brilho uniforme e um diafragma de fenda suficientemente estreito, bem como o alinhamento dos dois exatamente paralelos entre si. O alinhamento não requer apenas movimento nas direções xey, como com o scanner de ponto, mas também rotação. Se as duas bordas do diafragma com fenda não forem completamente uniformes e paralelas, isso pode causar listras na imagem, por exemplo, se houver acúmulo de poeira na borda do diafragma. Na prática, esses problemas significavam que tanto a linha de excitação quanto o diafragma de fenda eram consideravelmente mais largos do que deveriam ser teoricamente.
A linha de luz fluorescente pode ser capturada com um detector de linha CCD (com os dispositivos LSM5 live e Duo da Zeiss), ou a linha é mapeada em uma câmera usando um espelho móvel para que uma imagem seja construída linha por linha no chip de câmera (Meridian Insight, BioRad DVC 250). Devido à alta velocidade de digitalização, esta imagem também pode ser vista a olho nu através de uma ocular.
Em vez de uma linha, a amostra também pode ser iluminada com várias linhas adjacentes. O Zeiss CSM 700, que se destina ao exame de superfície de materiais, usa uma máscara de fenda no caminho do feixe de iluminação para criar um padrão listrado no espécime. Para detecção, o plano focal é mapeado no chip de uma câmera, a função da fenda do diafragma é simulada digitalmente apenas lendo alguns pixels. Ao mover a máscara de fenda, o espécime é finalmente totalmente capturado. Como a luz branca é usada para excitação, as imagens podem ser gravadas em cores reais. O exame de superfícies sem contato é possível trabalhando apenas com objetivas secas.
Microscópios confocais com discos Nipkow - varredura com muitos feixes de luz focalizados
Outra possibilidade para imagens confocais rápidas é o uso de muitos diafragmas pinhole usados em paralelo em um disco de Nipkow . O nome é um tanto enganoso: o disco que Paul Nipkow desenvolveu no século 19 para a transmissão de imagens de televisão continha uma espiral com furos. Em contraste, os discos Nipkow usados para microscopia confocal contêm muitos braços espirais próximos uns dos outros. A iluminação atinge o painel e passa parcialmente pelos diafragmas perfurados. Eles são diminuídos na amostra para gerar muitos pontos focais.
Ao girar o disco, os pontos focais fazem a varredura muito rapidamente sobre a amostra em arcos, de modo que uma imagem completa é criada em uma fração de segundo. Isso significa que a imagem também pode ser reconhecida a olho nu. Uma câmera é usada como detector e a seção da amostra examinada é digitalizada uma vez durante o tempo mínimo de exposição.
Microscópios com discos de Nipkow eram inicialmente inadequados para microscopia de fluorescência, pois os orifícios no disco de Nipkow deixavam passar menos de um por cento da iluminação. Como resultado, a excitação é muito fraca para a grande maioria das preparações marcadas com fluorescência. Embora existam dispositivos disponíveis para uso nas ciências da vida, eles não são amplamente utilizados. Somente por volta da virada do milênio a força do estímulo foi aprimorada por novas abordagens técnicas.
Scanner tandem para microscopia de reflexão de luz branca

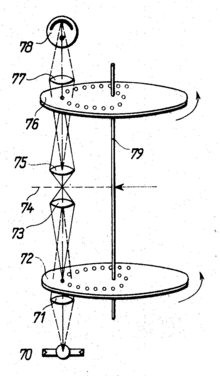
Na década de 1960, o checoslovaco Mojmír Petráň desenvolveu o "Tandem Scanning Microscope" (TSM), que tornou possível a microscopia de reflexão confocal. É assim chamado porque o caminho do feixe de iluminação passa por um lado do disco de Nipkow e o caminho do feixe de imagem passa pelo lado oposto. Os diafragmas perfurados em ambos os lados, portanto, são rasterizados quando o disco gira em conjunto. Cada orifício de iluminação corresponde a um orifício de detecção exatamente na posição oposta.
Para a versão original do microscópio, o disco de Nipkow com um diâmetro de 8,5 cm foi feito de folha de cobre fina de 20 micrômetros , em que 26.400 furos com um diâmetro de cerca de 90 micrômetros e uma distância média de 280 µm de centro a centro foram gravados . Os orifícios foram dispostos em 80 espirais de Arquimedes . O disco girou três vezes por segundo, o campo de observação foi varrido 120 vezes por segundo. A fonte de iluminação era uma lâmpada de tungstênio ou, para uma iluminação mais forte, uma imagem do sol.
A luz que passa pelo disco de Nipkow (destacada em vermelho no desenho) passa após várias reflexões para um espelho parcialmente transparente (acima da lente, 3), que reflete parte da iluminação para a lente. A parte da iluminação que passa por esse espelho se perde. A objetiva faz imagens dos diafragmas do orifício na amostra. A luz refletida nesses pontos é captada novamente pela lente e direcionada para o espelho parcialmente transparente. Desta vez, apenas a parte que passa é de interesse: ela é direcionada através de várias reflexões para o lado oposto do disco de Nipkow. Uma sofisticada técnica de fabricação garante que as duas metades da vidraça sejam opticamente idênticas, de modo que a luz refletida nos pontos de iluminação agora pode passar pelos diafragmas de orifício do plano focal de acordo com o princípio confocal.
Teoricamente, a iluminação com luz branca fornece uma imagem com cores reais. No entanto, mesmo uma ótica de vidro muito boa não pode evitar completamente a aberração cromática . Como resultado, a iluminação na preparação para cores diferentes está em planos ligeiramente deslocados.
A primeira publicação no microscópio de Petrá described descreveu as imagens dos gânglios espinhais e cérebros . Microscópios Tandem digitalização são usadas ainda hoje, por exemplo, ao examinar a córnea do olho .
Microscópios de disco Nipkow de um lado para microscopia de reflexão de luz branca
Em contraste com o scanner tandem, o disco de Nipkow é irradiado apenas em um lado: os mesmos diafragmas de orifício são usados primeiro para a iluminação e depois para a detecção.
Vindo de cima, a iluminação atinge primeiro um divisor de feixe, que direciona parte da luz para o disco de Nipkow. A porção que passa por aqui atinge o corpo de prova pela objetiva, onde é criado um ponto focal correspondente a cada orifício. A luz refletida volta para a lente e continua pelo mesmo orifício em direção ao divisor de feixe. Lá, ele é parcialmente espelhado para a câmera, o resto é perdido.
É importante evitar que a luz refletida do disco do Nipkow atinja a câmera. Isso pode ser feito espelhando o disco Nipkow e inclinando-o um pouco. No entanto, os diafragmas pinhole não estão mais na posição ideal. Para compensar isso, eles precisam ser um pouco maiores. Alternativamente, você pode trabalhar com luz polarizada.
Esses microscópios para imagens de reflexão são usados na ciência dos materiais para examinar superfícies, por exemplo, na indústria de semicondutores. Aqui eles são mais adequados do que os microscópios confocais de varredura a laser, uma vez que a luz coerente de um laser quando refletida em superfícies lisas leva a efeitos de interferência indesejáveis que são evitados quando iluminados com luz branca não coerente.
Potentes microscópios de disco giratório para espécimes fluorescentes
Um segundo disco com microlentes
A empresa japonesa Yokogawa foi a primeira a desenvolver um sistema de disco Nipkow confocal adequado para excitação por fluorescência, o disco giratório Yokogawa. Acima do disco Nipkow há um segundo disco que gira sincronizadamente e no qual são aplicadas microlentes. Cada orifício é precedido por uma microlente que focaliza a luz na abertura. Desta forma, mais de 60% passam para a preparação. O divisor de feixe dicróico necessário para a microscopia de fluorescência está localizado entre os dois painéis e desacopla a fluorescência que volta da amostra para o lado, em direção à câmera. Como resultado, a luz fluorescente passa pelos diafragmas do orifício, mas não pelo disco de microlentes, de modo que aqui as perdas de luz são evitadas. Além disso, a luz dispersa que ocorre no caminho do feixe de excitação quando atinge o disco de microlente não pode alcançar a câmera.
O bom rendimento de luz do sistema com cerca de 2.000 diafragmas de pinhole confocais usados simultaneamente permite observações em tempo real com uma relação sinal-ruído significativamente melhor do que os scanners de ponto confocal típicos com um número comparável de imagens por segundo. Uma vez que um ponto de imagem pode ser escaneado não apenas uma vez, mas com mais frequência em sucessão, a carga máxima do ponto de luz na amostra é menor do que em scanners de ponto típicos, de modo que os fluorocromos na amostra são menos branqueados . Os discos giram a 5 ou 10 revoluções por segundo. Alguns trabalhos publicados alcançaram taxas de quadros de 15 quadros por segundo. Os padrões redundantes nos discos significam que menos de uma revolução do disco é necessária para capturar uma imagem completa. Devido às altas taxas de quadros, em contraste com o scanner pontual, também é possível olhar a imagem confocal através da ocular com o olho.
A própria Yokogawa não oferece microscópios. Em vez disso, o componente descrito é construído em seus próprios dispositivos por outras empresas, como Leica Microsystems, PerkinElmer e Zeiss. Lasers são usados como fonte de luz porque permitem uma iluminação uniforme e forte. Portanto, esse tipo de dispositivo também é um microscópio confocal de varredura a laser. No entanto, o nome de microscópios de “disco giratório” se estabeleceu.
Um disco com espelhos côncavos
Till Photonics em Graefelfing desenvolveu uma abordagem alternativa para um bom rendimento de luz para excitação de fluorescência com discos Nipkow . Neste sistema "Andromeda", a luz laser é alimentada através de um chamado cubo de canto. A luz inicialmente passa direto por ele, é refletida pelo divisor de feixe dicróico e continua através de uma lente até o disco de Nipkow. No disco, cada um dos muitos diafragmas de orifícios é circundado por um espelho côncavo hexagonal . Apenas uma pequena quantidade de luz passa imediatamente pelos diafragmas do orifício. O resto é refletido de volta e encontra o cubo de canto após o divisor de feixe dicróico. Deste lado, o cubo de canto parece um espelho plano, de modo que a luz é direcionada de volta para o disco de Nipkow. Durante esta segunda passagem, devido ao efeito do espelho côncavo, a maior parte da luz passa pelos diafragmas do orifício e atinge o espécime. De acordo com o princípio confocal, a luz fluorescente que volta do espécime passa pelo disco de Nipkow para o divisor de feixe dicróico e, finalmente, para a câmera. Uma vantagem desse sistema é que os divisores de feixe dicróicos estão em uma área infinita do caminho do feixe. Como resultado, suas características são menos críticas para a qualidade da imagem.
Vantagens e desvantagens dos sistemas de disco Nipkow confocais em comparação com scanners pontuais
Devido ao uso simultâneo de muitos diafragmas de orifício e, portanto, de muitos pontos de iluminação, os sistemas baseados em discos Nipkow podem escanear uma amostra mais rápido do que um scanner de ponto. No entanto, em um sistema de painel Nipkow convencional, a maior parte da iluminação no painel é perdida. Enquanto a quantidade de luz que passa ainda é suficiente com microscópios de luz branca confocal, dispositivos de manutenção de luz são necessários para microscopia de fluorescência. No entanto, os sistemas deste tipo permitem que as células fluorescentes vivas sejam captadas mais suavemente, uma vez que a exposição máxima à luz de cada ponto é mais baixa (ver acima).
Ao usar vários diafragmas perfurados próximos um do outro no disco de Nipkow, é possível que a luz de um ponto da amostra possa alcançar a câmera através do diafragma perfurado errado e, assim, limitar a confocalidade da imagem. Este efeito dificilmente ocorre em exames materiais de superfícies. No entanto , isso pode se tornar um problema com espécimes biológicos mais espessos que estão espalhados . O efeito confocal é então enfraquecido conforme a profundidade do plano focal aumenta.
Além disso, com os sistemas de disco Nipkow, a região observável na preparação é fixa. Aumentar ou diminuir o zoom, ou seja, alterar o tamanho da região digitalizada como com o scanner de ponto, não é possível. Isso também não é problemático em exames de materiais, uma vez que as amostras não desbotam e, portanto, uma região reduzida não é uma vantagem. Uma ampliação maior também pode ser obtida aqui, alternando entre as lentes secas ou usando uma lente de aumento diretamente na frente da câmera. Por outro lado, os microscópios de fluorescência de disco giratório usados para observações de células vivas são geralmente do projeto inverso e são utilizadas objetivas de imersão , pois coletam uma proporção maior da fluorescência devido à maior abertura numérica . Uma vez que o líquido de imersão deve ser removido e reaplicado ao trocar as lentes, trocar as lentes é mais demorado. A ótica de zoom adicional sempre leva a uma ligeira perda de luz devido a reflexos nas superfícies de vidro adicionais, razão pela qual elas são dispensadas no caso de observações de fluorescência fraca em favor de uma sensibilidade mais alta.
Objetivas diferentes produzem discos de difração de tamanhos diferentes, dependendo da ampliação e da abertura numérica. O tamanho dos diafragmas pinhole em um disco não pode ser alterado, de modo que o tamanho ideal só pode ser alcançado para uma única objetiva ou para algumas objetivas. Já no caso de scanners pontuais, o tamanho do orifício pode ser adaptado à objetiva utilizada e ao comprimento de onda de excitação utilizado.
Os sistemas de disco Nipkow unilateral têm a vantagem de não ser necessário um ajuste dos diafragmas pinhole de excitação e emissão entre si, como é o caso dos leitores pontuais, uma vez que o mesmo conjunto de diafragmas pinhole é usado para ambos os fins.
Poder de resolução, seções ópticas e precisão de posicionamento
resolução
Como é geralmente o caso com microscópios de luz, a resolução dos microscópios confocais também é limitada pela difração . Uma fonte de luz pontual é devido à difração da função de espalhamento de ponto tridimensional (engl. Função de espalhamento de ponto , PSF) gerada por imagem. A seção através do plano médio do PSF é chamada de disco de difração (veja a ilustração). Por razões práticas, na microscopia confocal em vez da resolução ( critério de Rayleigh que) muitas vezes meia largura (ger.: Largura total meio máximo , FWHM) do PSF indicado, ou seja, a largura em que 50 por cento do brilho máximo estão disponíveis . Esses valores são geralmente um pouco mais baixos do que a resolução real.
Devido aos diafragmas de orifício nos caminhos de iluminação e feixe de detecção, a resolução confocal pode ser ligeiramente melhor do que em microscópios convencionais. A maior melhoria teórica possível na resolução pelo fator só é alcançada quando o orifício de detecção está quase completamente fechado, de forma que nenhuma luz mais seja capturada e, portanto, nenhuma imagem seja criada.
A resolução que pode realmente ser alcançada é, portanto, apenas ligeiramente melhor do que nos microscópios convencionais. Se o diâmetro da abertura está no primeiro mínimo do disco de difração (ou seja, no primeiro anel preto), a resolução no plano focal não é mais melhor do que no caso não confocal, enquanto a intensidade do sinal está quase no seu máximo . Esse valor geralmente é predefinido no software de microscópios confocais comerciais. É chamada de Unidade Airy (AU), após os termos ingleses disco Airy (= disco de difração) e unidade (= unidade de medida).
Como em geral com microscópios de luz, a resolução no plano focal é melhor do que ao longo do eixo óptico ( resolução anisotrópica ). A tabela mostra as fórmulas para calcular a meia largura da função de dispersão de pontos.
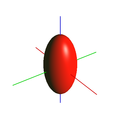
| Ø> 1 AU | Ø <0,25 UA | NA objetivo = 1,4 / n = 1,518 para Ø = 1 - 0,25 AU (λ = 500 nm) |
isosuperfície de volume confocal de igual intensidade |
|
|---|---|---|---|---|
| FWHM lateral | 182-132 nm |
|
||
| FWHM axial | 473 - 344 nm | |||
|
Fórmulas para calcular a meia largura (FWHM) da função de propagação de pontos (PSF) com um diâmetro Ø do orifício de detecção de> 1 AU (coluna 2) e <0,25 AU (coluna 3). NA: abertura numérica da objetiva; λ: comprimento de onda da luz; n: índice de refração do meio de imersão (1 para ar). A coluna 3 contém um exemplo de objetiva de imersão em óleo de alta qualidade, a coluna 4 uma representação do volume do qual o sinal chega ao detector (eixo óptico vertical).
| ||||
As relações descritas aplicam-se apenas às condições ópticas ideais. Uma dessas condições é uma iluminação completamente uniforme do plano focal posterior da objetiva pela luz de excitação, pois somente então surge um disco de difração ideal no corpo de prova. No entanto, a seção transversal do brilho de um feixe de laser mostra aproximadamente uma distribuição Gaussiana . A fim de minimizar o efeito negativo, a pupila traseira da lente é superexposta, isto é, o feixe de laser é alargado tanto que as áreas externas são cortadas e a seção transversal restante tem menos diferenças no brilho. Se for alargado tanto que 50% da luz ainda consegue passar, a perda de resolução ainda fica em torno de 8%; se 30% ainda penetram, a perda é de 5%. Além disso, ao examinar a fluorescência, há uma diferença entre os comprimentos de onda de excitação e detecção ( deslocamento de Stokes ), o que leva a uma perda adicional de resolução. O comprimento de onda médio é aproximado .
Uma outra perda de resolução pode ser causada na amostra, se o índice de refracção da incorporação meio ou os tampa se desvia da espessura do deslizamento a partir dos valores previstos para o objectivo e isso resulta em aberrações esféricas .
Limitação axial do sinal e precisão de posicionamento
A ligeira melhora na resolução dificilmente justifica o esforço aumentado e os custos associados. A vantagem decisiva dos microscópios confocais é antes a possibilidade de fazer cortes ópticos, pois devido aos diafragmas pinhole, a intensidade do sinal cai aproximadamente com a quarta potência da distância ao plano focal (1 / distância 4 ). O efeito pode ser explicado usando o exemplo de uma superfície reflexiva. Em microscópios de luz incidente convencionais, a posição exata da superfície não pode ser determinada porque a quantidade de luz refletida é a mesma nos níveis acima e abaixo. No microscópio confocal, entretanto, a luz só é detectada quando a superfície reflexiva está na área do plano focal. Como resultado, a precisão da determinação de uma posição é muito alta. O contraste em amostras fluorescentes também é melhorado, uma vez que nenhuma fluorescência de outros níveis atinge o detector.
A precisão com a qual uma posição pode ser determinada é consideravelmente melhor do que a resolução alcançável, uma vez que o centro de um brilho máximo pode ser determinado com muita precisão (veja a figura). Como resultado, a resolução alcançável não é alcançada, uma vez que não pode ser determinado se o sinal gravado se origina de uma ou mais estruturas próximas. Essa restrição é irrelevante se a altura das superfícies for medida na pesquisa de materiais . Essa medida de altura, portanto, não é limitada pela resolução. O fator limitante é a incerteza com a qual a posição da intensidade máxima ao longo do eixo óptico pode ser determinada. A incerteza é limitada principalmente pelo ruído do sistema e é de apenas alguns nanômetros em um microscópio confocal bem construído ao usar uma objetiva de alta abertura.
Procedimentos relacionados
Técnicas confocais não microscópicas
As técnicas confocais também são usadas fora da microscopia, por exemplo, para medições de distância confocal cromática . O artigo Confocal Technology oferece uma visão geral .
Na medicina, a endomicroscopia confocal é usada como método de endoscopia .
Outros microscópios de varredura a laser
- veja também: Microscópios de Varredura a Laser
Até certo ponto, os precursores dos microscópios confocais de varredura a laser são microscópios pontuais voadores . Tal como acontece com os scanners de ponto confocal, um ponto de iluminação é guiado sobre a amostra. No entanto, isso não é necessariamente limitado pela difração. Um orifício de detecção também está faltando. Nos primeiros dispositivos, o ponto de iluminação era frequentemente gerado por um tubo de Braun e, após o desenvolvimento do laser, também por um feixe de laser focalizado. Esses dispositivos foram os primeiros microscópios de varredura a laser.
Outros microscópios de varredura a laser, por outro lado, só foram construídos após o desenvolvimento do microscópio de varredura a laser confocal. Os microscópios 4Pi e STED são microscópios confocais especiais que permitem uma resolução melhorada. A microscopia multifotônica , por outro lado, é um método de varredura a laser não confocal, uma vez que não são necessários diafragmas de orifício com pontos focais confocais. Um sinal é gerado aqui apenas quando dois ou mais fótons chegam ao ponto focal ao mesmo tempo, daí o nome. Os três métodos mencionados são frequentemente incorporados como um acessório para um microscópio confocal de varredura a laser.
história
1940: um sistema de lâmpada de fenda para documentar exames oftalmológicos
O oftalmologista Hans Goldmann , diretor da University Eye Clinic em Bern , Suíça , lutou com o problema de que as lâmpadas de fenda só focam nitidamente em uma parte muito limitada do olho ( córnea ou parte da lente ). Enquanto um observador pode compor uma imagem contínua em sua mente, uma representação fotográfica sempre foi limitada a uma área estreita. Goldmann desenvolveu um dispositivo para “fotografia e fotometria com lâmpada de fenda”, que foi fabricado pela empresa local Haag-Streit .
A parte nítida da imagem foi projetada no filme através de uma lente . Uma abertura em forma de lacuna na frente do filme evitou que partes borradas da imagem fossem fotografadas. O mecanismo para mover a fenda de iluminação estava firmemente conectado ao tambor do filme por meio de um disco: se a fenda da imagem nítida se movesse sobre o olho, o filme no tambor giraria de acordo atrás do diafragma da fenda.
A iluminação através de uma lacuna corresponde aproximadamente a um disco de luz , então a iluminação não é focada em uma linha, como em scanners de linha confocal posteriores. No entanto, o eixo de observação no aparelho de Goldmann estava aproximadamente em um ângulo de 45 ° com o eixo de iluminação, de modo que - visto do detector - apenas uma linha (e não os níveis abaixo ou acima) era iluminada. A função da lacuna na frente da câmera correspondia ao diafragma de fenda na frente do detector de um scanner de linha confocal, de modo que o sistema foi posteriormente referido como confocal.
O trabalho de Goldmann foi citado na década de 1970 por DM Maurice, que desenvolveu um microscópio confocal de varredura linear para oftalmologia. O aparelho de Goldmann também menciona retrospectivas históricas.
1943, 1951: microscópios confocais para espectrofotometria
Publicado em 1943 Zyun Koana um trabalho em um micro confocal fotometria sistema. Uma figura mostra o esquema de um caminho de feixe de transmissão confocal: A iluminação passa por duas lentes e o orifício de excitação para outra lente (correspondendo ao condensador em microscópios de luz normais), da qual é focada na amostra. A luz passa pela amostra e é focada em um orifício de detecção por outra lente (correspondente à objetiva). Não há tradução ou resumo em uma língua ocidental desta obra japonesa. Koana (1907–1985) mais tarde ficou conhecido por desenvolver lentes de câmera em colaboração com a empresa Nikon .
Hiroto Naora, um colega de trabalho de Koana, publicou um artigo na revista Science em 1951 . Ele focalizou um diafragma pinhole no caminho do feixe de iluminação, reduzido 2.000 vezes, no espécime. Um segundo orifício no plano intermediário da imagem minimizou a luz difusa durante a exposição. O objetivo era iluminar pequenas áreas no núcleo das células em que o DNA foi detectado com a coloração de Feulgen , a fim de determinar a quantidade de DNA quantitativamente. O microscópio não produziu nenhuma imagem, em vez disso, mediu-se a intensidade e os comprimentos de onda da luz transmitida pelo corpo de prova ( espectrofotometria ). Os dois diafragmas perfurados evitam a dispersão de luz e, assim, melhoram a precisão da medição. O ponto de iluminação produzido tinha um diâmetro de 1-5 μm e, portanto, não era limitado por difração. A amostra também não foi digitalizada.
1955, 1957: o primeiro scanner de ponto

O primeiro microscópio confocal de varredura pontual foi desenvolvido por Marvin Minsky em 1955 e uma patente foi solicitada em 1957. Ele queria examinar seções do cérebro e estava lutando contra a dispersão severa neste tecido denso. Visto que a luz difusa brilhante impedia que as estruturas reais fossem reconhecidas, ele procurou uma maneira de reduzir isso e encontrou no princípio confocal.
O microscópio tinha, um percurso do feixe horizontal fixa (ver esquema) e um de zircónio - lâmpada de arco como uma fonte de luz. A abertura do primeiro orifício foi focada no espécime por meio de uma objetiva seca de 45x. O espécime foi colocado entre duas lâminas de vidro e preso em um dispositivo móvel que foi movido nas direções xey para digitalização (“digitalização de palco”). A segunda lente do mesmo tipo captava a luz que havia passado e a passava pelo segundo orifício até o detector. Minsky nunca usava imersão em óleo porque temia que a viscosidade pudesse causar problemas com o movimento do corpo de prova e que a profundidade de penetração mais baixa das objetivas de imersão em óleo não fosse suficiente. O sistema foi capaz de resolver pontos separados por menos de um micrômetro.
O detector era um fotomultiplicador e o dispositivo de exibição era uma tela de radar ( tubo de raios catódicos ) com um tempo de exibição de imagem de cerca de dez segundos. Este também foi o tempo que levou para rasterizar uma imagem. Nenhuma digitalização ou documentação fotográfica foi incorporada e nenhuma imagem sobreviveu. Minsky mais tarde citou a falta de opções de documentação como uma das razões pelas quais demorou mais 30 anos para a ideia do microscópio confocal se firmar.
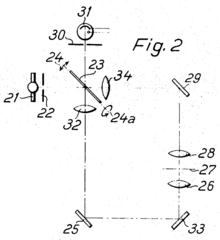
Minsky não escreveu nenhum artigo científico mencionando o microscópio confocal. Seu cunhado, advogado de patentes , achou o dispositivo interessante e, portanto, era a única documentação contemporânea em um pedido de patente . Isso também descreve a estrutura de uma segunda versão na qual a luz passa pelo espécime, atinge um espelho e é refletida de volta por ele (veja a ilustração). Ele também mencionou a possibilidade de escanear ao longo do eixo óptico (direção z), que ele também não percebeu.
1966: "Dispositivo para varredura óptica de objetos microscópicos"
Menos conhecido é o desenvolvimento de várias abordagens para microscópios de varredura confocal por Klaus Weber, funcionário da Ernst Leitz GmbH em Wetzlar . Como no caso de Koana e Naora, o objetivo não era criar uma imagem, mas medir a intensidade do sinal em pequenas seções do espécime.
Weber forneceu três opções alternativas de varredura "para varredura síncrona no lado da iluminação e observação":
- Um disco de Nipkow clássico (cada um com apenas uma espiral de diafragma pinhole) entrou no plano do diafragma de campo luminoso e um segundo disco , correndo sincronicamente no plano da imagem intermediária (veja a figura à esquerda).
- Em cada um dos campos luminosos e do plano intermediário da imagem havia um orifício de pino móvel, que era movido eletricamente de forma síncrona em uma direção (eixo x). A rasterização ao longo do eixo y foi feita movendo o objeto ou também movendo o orifício.
- Este "arranjo particularmente vantajoso" usava um espelho inclinado que movia a imagem do orifício de iluminação ("ponto de parada de luz") como um "ponto de luz" sobre o espécime, e sobre o qual o caminho do feixe de observação para o orifício de detecção ("ponto de parada ") corrido. O espécime estava estacionário e foi escaneado mudando o caminho do feixe (varredura do feixe).
Walter novamente sugeriu várias versões da variante do espelho basculante. A iluminação e a luz de observação deveriam passar pelo mesmo lado do espelho, ou, "particularmente útil", o caminho do feixe de observação corria pelo lado traseiro, que também era espelhado, de modo que os caminhos de iluminação e do feixe de observação eram separados, mas ainda sincronizado, de modo que aquele na amostra O ponto de luz gerado sempre foi mapeado no orifício de detecção. Para esta solução, o pedido de patente apresenta uma versão para luz transmitida e outra para microscopia de reflexão de luz incidente (ver figuras). A possibilidade de usar o sinal elétrico do detector para criar uma imagem, como acontece com o microscópio Minsky, não foi mencionada nas patentes.
Não está claro se os dispositivos propostos por Weber foram realmente construídos e se suas idéias tiveram influência em desenvolvimentos posteriores. A primeira patente citando a patente de Weber nos Estados Unidos foi registrada em 1980.
Weber não foi o primeiro a ter a ideia de usar um disco de Nipkow em microscópios. Já em 1951, foi apresentado um sistema no qual um disco de Nipkow clássico era usado para quebrar uma imagem de fluorescência de tal forma que o brilho dos pixels individuais pudesse ser medido um após o outro por um fotomultiplicador. Portanto, não era um sistema de imagem confocal, mas um “scanner microfluorométrico”.
1967: o primeiro microscópio confocal de imagem com um disco de Nipkow
Na década de 1960, o tchecoslovaco Mojmír Petráň da Faculdade de Medicina da Charles University em Pilsen desenvolveu o microscópio de varredura tandem descrito acima . Foi o primeiro microscópio confocal colocado à venda: por um lado, por uma pequena empresa na Tchecoslováquia e, por outro lado, nos EUA pela Tracor-Northern (mais tarde Noran).
O médico treinado Petráň visitou o grupo de pesquisa de Robert Galambos na Yale University em New Haven (Connecticut, EUA) em 1964 . Eles pensaram em como as células nervosas não corrigidas e não coradas no cérebro poderiam ser observadas e desenvolveram o conceito durante esta estadia. No ano seguinte, Petráň e Milan Hadravský construíram o primeiro protótipo em Pilsen.
A patente da Checoslováquia foi depositada em 1966 por Petráň e Hadravský. Em 1967, apareceu a primeira publicação científica na revista Science , que continha dados e imagens obtidas com o microscópio. Os autores foram M. David Egger da Yale University e Petráň. As notas de rodapé deste artigo dizem que Petráň projetou o microscópio e direcionou sua construção e que às vezes foi pesquisador associado na Universidade de Yale. Outra obra surgiu em 1968, na qual Hadravský e Galambos também eram autores. A teoria e os detalhes técnicos do microscópio foram descritos aqui. Em 1970, a patente norte-americana solicitada em 1967 foi concedida. Também contém uma versão do microscópio para luz transmitida: o espécime é iluminado por uma objetiva e observado por outra, de construção idêntica. No entanto, não está claro se essa variante foi realmente construída.
No encontro anual da European Light Microscopy Initiative (ELMI) em 2011, Petráň e Hadravský foram homenageados por seus serviços, e em 2012 ambos foram nomeados pelo projeto Capital Europeia da Cultura “Plzeň 2015” e “Pilsen icons” em sua cidade natal. Hadravský recebeu esta homenagem in memoriam .
Não foi até 1986 que o microscópio de varredura tandem foi usado para examinar o olho . Após testes ex vivo bem-sucedidos , cientistas da Universidade de Georgetown, nos Estados Unidos, desenvolveram o dispositivo para que também pudesse ser usado em pacientes. Uma versão comercial foi desenvolvida pela Tandem Scanning Corporation, Inc. O dispositivo continha uma lente adicional, cujo movimento mudava o plano de foco do olho sem ter que mover a lente.
1969: o primeiro microscópio confocal de varredura a laser
Egger estava envolvido em mais um desenvolvimento. Junto com Paul Davidovits , também na Universidade de Yale, ele publicou dois artigos em 1969 e 1971 sobre o primeiro microscópio confocal que funcionou com luz laser, um scanner pontual. Este dispositivo também foi projetado para microscopia de reflexão de luz refletida, em particular para a observação de tecido nervoso. Já em 1969, os autores especularam sobre o uso de corantes fluorescentes para investigações " in vivo ". Eles citaram a patente de Minsky e agradeceram a Steve Baer por sugerir o uso de um laser com 'microscópio de Minsky', assim como Galambos, Hadravsky e Petráň pelas discussões que levaram ao desenvolvimento do microscópio. Baer era um estudante de doutorado na Escola de Medicina Albert Einstein na cidade de Nova York , onde desenvolveu um microscópio confocal de varredura linear. Como motivação para o novo desenvolvimento, Egger e Davidovits afirmaram no segundo trabalho que no microscópio de varredura em tandem apenas 10-7 da iluminação na ocular contribuíram para a formação da imagem e que a qualidade da imagem era, portanto, insuficiente para a maioria dos produtos biológicos investigações.
Um laser de hélio-neon com comprimento de onda de 633 nm e potência de 5 mW foi direcionado para um espelho semitransparente e refletido deste para a objetiva. Uma lente simples com uma distância focal de 8,5 mm serviu como objetivo . Em contraste com todos os desenvolvimentos anteriores e posteriores, o espécime foi escaneado movendo esta lente (varredura objetiva), que mudou o ponto de foco de acordo. A luz refletida voltou para o espelho semitransparente, e a porção transmitida foi guiada por outra lente para o orifício de detecção, atrás do qual um fotomultiplicador foi localizado. O sinal era exibido pelo tubo de raios catódicos de um osciloscópio , com o raio catódico movendo-se em sincronismo com a lente. Aparelhos especiais foram capazes de tirar fotos Polaroid do anúncio, três das quais foram reproduzidas na publicação de 1971. A luz laser é basicamente polarizada linearmente . Na primeira das duas publicações, um analisador (um filtro de polarização ) na frente do orifício de detecção evitou que a luz refletida dentro do microscópio chegasse ao detector. Uma placa de λ / 4 entre a objetiva e a amostra garantiu que a luz refletida pela amostra fosse deslocada em um total de 90 ° em relação à polarização do laser para que passasse pelo analisador. Na versão do microscópio da segunda publicação, no entanto, esses dois componentes estavam faltando.
Davidovits, Egger e Marvin Minsky recebeu o Prêmio de madeira RW do Optical Society of America em 2000 para contribuições para o desenvolvimento do microscópio confocal.
1977–1985: Scanner de ponto com laser e rasterização por movimento do espécime (digitalização em estágio)
Colin JR Sheppard e A. Choudhury de Oxford publicaram uma análise teórica de microscopia confocal e microscopia de varredura a laser em 1977. Este trabalho é provavelmente a primeira publicação a conter o termo “microscópio confocal”.
Em 1978, os irmãos Christoph Cremer e Thomas Cremer em Heidelberg projetaram um microscópio confocal de varredura a laser para excitação de fluorescência com foco automático eletrônico . Eles escreveram: “Devido às suas opções especiais de exibição, o método do microscópio de varredura a laser pode ser uma adição valiosa aos métodos convencionais de microscopia de luz e microscópica eletrônica de varredura.” Eles também sugeriram a iluminação de ponto a laser usando um “ holograma de ponto 4π ”.
O grupo de Oxford em torno de Sheppard e Tony Wilson descreveu em 1978 e 1980 um microscópio confocal de luz refletida com varredura de palco, iluminação a laser e fotomultiplicadores como detectores. O corpo de prova podia ser movido não apenas no plano focal, mas também ao longo do eixo óptico, o que possibilitou o registro de cortes seriais ópticos. As vantagens do dispositivo podem ser demonstradas de maneira particularmente convincente em circuitos eletrônicos integrados . O termo e o método de "corte óptico" são, entretanto, mais antigos. Já em 1930, Francis Lucas mostrou cortes óticos em série que produzia em filme com um microscópio de luz UV.
Fred Brakenhoff e colaboradores provaram em 1979 que as vantagens teóricas das seções ópticas e a melhoria na resolução podem realmente ser alcançadas. Em 1985, o grupo publicou as primeiras imagens convincentes sobre questões biológicas celulares, que eles obtiveram com um microscópio confocal avançado. Outras aplicações biológicas seguidas logo em seguida por outros grupos.
Nesse ínterim, IJ Cox e Sheppard do grupo Oxford publicaram o primeiro trabalho em um microscópio confocal conectado a um computador em 1983.
O primeiro microscópio confocal de varredura a laser comercial, o scanner de estágio SOM-25, foi oferecido a partir de 1982 pela Oxford Optoelectronics (adquirida pela BioRad por meio de etapas intermediárias); foi baseado no design do Grupo Oxford.
A partir de 1985: scanner de ponto a laser com varredura de feixe
A maioria dos microscópios confocais de varredura a laser desenvolvidos até agora pertenciam ao tipo de varredura de estágio: O ponto de iluminação era imóvel e o palco com o espécime era movido nas direções xey para escanear os objetos no plano focal. Este procedimento era lento e sensível ao choque. Minsky já havia mencionado a possibilidade de girar um feixe de luz de varredura sobre o espécime imóvel, mas o descartou devido a dificuldades técnicas.
Em meados da década de 1980, WB Amos, JG White e colegas em Cambridge desenvolveram o primeiro microscópio de varredura de feixe confocal ( feixe , inglês para feixe, feixe de luz) no qual o espécime fica parado e o ponto de iluminação é movido. Isso possibilitou gravar quatro imagens por segundo com 512 linhas cada. A ideia de varredura de feixe foi adotada a partir de microscópios de spot voador . Um segundo novo desenvolvimento importante foi um plano de imagem intermediário muito ampliado através de um caminho de feixe que era de um a dois metros mais longo. Como resultado, a imagem intermediária gerada foi 80 vezes maior do que com o aumento da lente, com o resultado de que um diafragma de íris comum com um diâmetro de cerca de um milímetro poderia ser usado para o orifício , em contraste com os diafragmas de orifício em sistemas anteriores, que tinham apenas algumas dezenas de micrômetros de tamanho. Isso tornou o ajuste muito mais fácil.
As primeiras fotos foram tiradas com iluminação de longo prazo com filme antes de uma câmera digital ser instalada. As imagens de várias amostras biológicas foram significativamente melhores em comparação com a microscopia de fluorescência normal. Essas imagens foram publicadas pela primeira vez em 1987. Outro aprimoramento do dispositivo tornou possível, pela primeira vez, ampliar o corpo de prova, ou seja, selecionar uma subárea para uma exibição ampliada ou uma imagem mais rápida. Zeiss , Leitz e Cambridge Instruments não tinham interesse na produção comercial. No entanto, o Medical Research Council (MRC) concordou em financiar o desenvolvimento de um protótipo mais compacto. Eventualmente, a Bio-Rad fez o design e o software para controle de computador foi desenvolvido. O dispositivo chegou ao mercado como MRC 500, o sucessor foi chamado de MRC 600. Esse dispositivo também foi a base para o primeiro microscópio de fluorescência de dois fótons desenvolvido na Cornell University nos Estados Unidos e publicado em 1990 .
Ao mesmo tempo, houve um novo desenvolvimento na Universidade de Estocolmo , que quase ao mesmo tempo levou a um dispositivo comercial que foi vendido pela empresa sueca Sarastro. Foi adquirida pela Molecular Dynamics, uma empresa americana, em 1990, mas a produção acabou por cessar. Na Alemanha, a Heidelberg Instruments , fundada em 1984, desenvolveu um microscópio confocal de varredura a laser que foi desenvolvido menos para aplicações biomédicas do que industriais. Este dispositivo foi adquirido e desenvolvido pela Leica Lasertechnik em 1990 . A Zeiss já tinha um microscópio de varredura a laser não confocal de ponto voador no mercado que foi expandido para um microscópio confocal. Um relatório de 1990 que menciona "alguns" fabricantes listados a seguir: Sarastro, Technical Instrument, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern e Zeiss.
Novos desenvolvimentos com lavadora Nipkow
Os muitos espelhos e prismas do scanner em tandem, que coordenam e ajustam com precisão os diafragmas do orifício de excitação e os diafragmas do orifício de detecção no caminho do feixe, são difíceis; A vibração do fino disco de Nipkow também leva a dificuldades de ajuste. Egger e Petráň já propuseram que o caminho do feixe de excitação e detecção fosse guiado pelos mesmos diafragmas pinhole (“disco de Nipkow unilateral”). No entanto, eles rejeitaram esta abordagem porque a reflexão da luz de excitação na superfície do painel não pôde ser separada do caminho do feixe de detecção. Albert Frosch e Hans Erdmann Korth receberam uma patente americana da IBM em 1975 , na qual esse problema foi resolvido inclinando o disco Nipkow.
Com mais melhorias, essa ideia se tornou a base para uma patente registrada em 1988 por Gordon S. Kino e Guoqing Xiao, da Universidade de Stanford , em um microscópio de disco Nipkow de face única para microscopia de reflexão de luz refletida. O dispositivo foi projetado para medição de semicondutores . As vantagens foram uma menor suscetibilidade a vibrações e um ajuste simplificado. Além disso, o disco de Nipkow pode agora ser movido transversalmente ao caminho do feixe, de modo que diafragmas com aberturas de tamanhos diferentes possam ser fixados em trilhas diferentes entre o centro do disco e a borda. Isso permitiu que o tamanho da abertura fosse adaptado à resolução de diferentes objetivos ou aos diferentes níveis de reflexão de diferentes regiões do espécime.
Para reduzir a reflexão diretamente do disco Nipkow para o detector, foi instalado um disco escurecido inclinado 5 ° em relação ao eixo óptico. Depois da fonte de luz veio um polarizador e atrás dele um espelho semitransparente que refletia para o disco de Nipkow. Entre o disco e a lente havia uma placa de um quarto de onda , no caminho de retorno da luz, diretamente em frente ao detector, havia um analisador . Embora uma grande parte da luz tenha sido perdida dessa forma, a luz refletida diretamente do disco de Nipkow foi bloqueada efetivamente pelo analisador.
Ichihara e seus colegas publicaram o primeiro artigo sobre o sistema de disco giratório Yokogawa em 1996 (veja acima ).
Links da web
- Optical Microscopy Primer (Inglês) Coleção extensa de links para descrições detalhadas de microscopia, incluindo microscópios confocais virtuais
- Microscopia de varredura a laser confocal Introdução à microscopia confocal da Zeiss (arquivo PDF, 884 KB)
literatura
leitura adicional
- Michael Volger: Microscopia de luz - teoria e aplicação. Irene K. Lichtscheidl, Universidade de Viena (Ed.), Edição online de 29 de fevereiro de 2008, arquivo PDF em: univie.ac.at . (Tratado sobre microscopia de luz, pp. 174-220 sobre fluorescência e microscopia confocal.)
- Michiel Müller: Introdução à Microscopia de Fluorescência Confocal (Textos Tutoriais em Engenharia Ótica) . 2ª Edição. SPIE Press, 2006, ISBN 0-8194-6043-5 . Site do editor (introdução à microscopia de fluorescência confocal.)
- Guy Cox: Técnicas de Imagem Ótica em Biologia Celular . 1ª edição. CRC Press, Taylor & Francis Group, Boca Raton FL 2006, ISBN 0-8493-3919-7 . (2ª edição. 2012, ISBN 978-1-4398-4825-8 ) (Introdução geral à microscopia de luz, com capítulos específicos sobre microscopia confocal e imagens digitais, aberrações, fluorescência, etc.)
- James Pawley (Ed.): Handbook of Biological Confocal Microscopy . 3ª Edição. Springer Science and Business Media, 2006, ISBN 0-387-25921-X . ( O trabalho de referência para microscopia confocal nas ciências da vida, menos destinado a iniciantes.)
Evidência individual
- ↑ a b c d Guy Cox: Técnicas de Imagem Ótica em Biologia Celular . 1ª edição. CRC Press, Taylor & Francis Group, Boca Raton FL 2006, ISBN 0-8493-3919-7 , pp. 57-75 .
- ^ A b Colin JR Sheppard, David M. Shotton: Microscopia de varredura do laser confocal . In: Royal Microscopical Society Microscopy Handbooks . fita 38 . BIOS Scientific Publishers Limited, Oxford, UK 1997, ISBN 1-872748-72-4 , pp. 37, 39-42 .
- ↑ Detector híbrido R10467U-40 ( página não mais disponível , pesquise nos arquivos da web ) Informação: O link foi automaticamente marcado como defeituoso. Verifique o link de acordo com as instruções e, em seguida, remova este aviso. do site da Hamamatsu Photonics KK, acessado em 4 de dezembro de 2012.
- ↑ Leica HyD para imagem confocal. (PDF; 1,9 MB) Leica Microsystems, acessado em 9 de fevereiro de 2016 .
- ↑ O detector híbrido HPM-100-40. (PDF; 1,4 MB) Becker & Hickl GmbH, acessado em 9 de fevereiro de 2016 .
- ↑ Série PMA Hybrid | PicoQuant. PicoQuant GmbH, acessado em 14 de julho de 2017 .
- ↑ Microscópios confocais com varredura de estágio são oferecidos por vários fabricantes (por exemplo, MicroTime da PicoQuant , DeltaMyc da Horiba ).
- ↑ a b c P. Davidovits, MD Egger: Microscópio de varredura a laser para investigações biológicas. In: Óptica aplicada. Volume 10, Número 7, julho de 1971, pp. 1615-1619, ISSN 0003-6935 . PMID 20111173 . doi: 10.1364 / AO.10.001615
- ↑ a b MicroTime do PicoQuant , site do fabricante, acessado em 14 de julho de 2017.
- ↑ DeltaMyc da Horiba , site do fabricante, acessado em 14 de julho de 2017.
- ↑ Alba FCS , site do fabricante, acessado em 26 de janeiro de 2012.
- ↑ site do microscópio confocal Raman Witec ( Memento de 22 de dezembro de 2012 no Internet Archive pelo fabricante), acessado em 26 de janeiro de 2012.
- ↑ a b c d e f g h i j k l m n o p Guy Cox: Técnicas de Imagem Ótica em Biologia Celular . 1ª edição. CRC Press, Taylor & Francis Group, Boca Raton FL 2006, ISBN 0-8493-3919-7 , pp. 115-122 .
- ↑ Site da Zeiss para o microscópio confocal true color Axio CSM 700 , também disponível como arquivo PDF, acessado em 26 de janeiro de 2012.
- ↑ a b c d J. C. Erie: Cicatrização de feridas na córnea após ceratectomia fotorrefrativa: um estudo de microscopia confocal de 3 anos. In: Transactions of the American Ophthalmological Society. Volume 101, 2003, pp. 293-333, ISSN 0065-9533 . PMID 14971584 . PMC 1358995 (texto completo gratuito).
- ^ A b c Egger MD, Petrăn M: Novo microscópio de luz refletida para ver o cérebro não manchado e as células ganglionares . In: Science . fita 157 , no. 786 , julho de 1967, p. 305-7 , doi : 10.1126 / science.157.3786.305 , PMID 6030094 .
- ^ A b Mojmír Petráň, Milan Hadravský: Método e arranjo para melhorar o poder de resolução e o contraste. online no Google Patents, depositado em 4 de novembro de 1967, emitido em 30 de junho de 1970.
- ↑ a b c Mojmír Petráň, Milan Hadravský, M. David Egger, Robert Galambos: Tandem-Scanning Reflected-Light Microscope . In: Journal of the Optical Society of America . fita 58 , não. 5 , 1968, pág. 661-664 , doi : 10.1364 / JOSA.58.000661 .
- ↑ Heike Schmidt, Jürgen Valentin: Medição confocal - medição de superfície 3D usando um microscópio. In: Practice Profiline. Novembro de 2006. Arquivo PDF
- ↑ Andromeda iMIC - Imagens de células vivas de alta velocidade com resolução confocal. Brochura da Till Photonics. Disponível online como arquivo PDF ( Memento de 16 de agosto de 2012 no Internet Archive )
- ↑ a b c B. Amos, G. McConnell, T. Wilson: Confocal microscopy. Em: E. Egelman (Ed.): Comprehensive Biophysics. Elsevier, Amsterdam 2012.
- ^ G. Cox, CJ Sheppard: Limites práticos da resolução na microscopia confocal e não linear. In: Pesquisa e técnica microscópica. Volume 63, Número 1, janeiro de 2004, pp. 18-22, ISSN 1059-910X . doi: 10.1002 / jemt.10423 . PMID 14677129 .
- ↑ a b c Stefan Wilhelm, Bernhard Gröbler, Martin Gluch, Hartmut Heinz: A microscopia confocal de varredura a laser . Edição 09/03. Sistemas de microscópio Carl Zeiss, Jena 2003 ( PDF; 884kB ).
- ↑ a b c d e f W. B. Amos, JG White: Como o microscópio confocal de varredura a laser entrou na pesquisa biológica. In: Biologia da célula / sob os auspícios da European Cell Biology Organisation. Volume 95, Número 6, setembro de 2003, pp. 335-342, ISSN 0248-4900 . PMID 14519550 . (Análise).
- ↑ VDI / VDE 2655-1.2: Tecnologia de medição óptica em microtopografias; Calibração de microscópios confocais e padrões de configuração de profundidade para medição de rugosidade. Rascunho de conteúdo (PDF; 112 kB)
- ↑ M. Françon: Introdução aos novos métodos de microscopia ótica . Verlag G. Braun, Karlsruhe 1967, p. 253-256 .
- ^ A b Hans Goldmann: Fotografia e fotometria da lâmpada de fenda . In: Ophthalmologica . fita 98 , no. 6/5 , 1939, pp. 257-270 , doi : 10.1159 / 000299716 . Nota: O volume 98 é atribuído ao ano de 1939, mas janeiro de 1940 é dado como a data de publicação na primeira página do artigo.
- ↑ a b c d e f g h Colin JR Sheppard: Microscopia Confocal. O Desenvolvimento de uma Microscopia Moderna . In: Imaging & Microscopy . 3 de novembro de 2009 ( online [acessado em 17 de novembro de 2012]).
- ↑ a b Barry R. Masters: Microscopia Confocal e Microscopia de Excitação Multifotônica. The Genesis of Live Cell Imaging . SPIE Press, Bellingham, Washington, USA 2006, ISBN 978-0-8194-6118-6 , pp. 120-121 .
- ↑ Barry R. Masters: Microscopy Confocal And Multiphoton Excitation Microscopy. The Genesis of Live Cell Imaging . SPIE Press, Bellingham, Washington, USA 2006, ISBN 978-0-8194-6118-6 , pp. 126 .
- ↑ Zyun Koana:微小 部 濃度 計 に 關 す る 諸 問題. In: Journal of the Illumination Engineering Institute . fita 26 , não. 8 , 1942, pp. 371-385 . O trabalho ( arquivo PDF online , 19020 kilobytes) A Figura 1b do trabalho (p. 373) mostra o esquema de um caminho de feixe de transmissão confocal
- ↑ Dr. Exposição especial de Zyun Koana na Universidade de Tóquio ( lembrança de 2 de abril de 2015 no Internet Archive ), site de Michio Akiyama, acessado em 8 de janeiro de 2013.
- ↑ Hiroto Naora: Microspectrofotometria e análise citoquímica de ácidos nucléicos. In: Science. Volume 114, Número 2959, setembro de 1951, pp. 279-280, ISSN 0036-8075 . PMID 14866220 . doi: 10.1126 / science.114.2959.279
- ^ Marvin Minsky: Aparelho de microscopia. Patente U.S. 3.013.467 , depositada em 7 de novembro de 1957, emitida em 19 de dezembro de 1961.
- ↑ a b c d Marvin Minsky : Memórias sobre a invenção do microscópio de varredura confocal . In: Scanning . fita 10 , não. 4 , 1988, pp. 128-138 , doi : 10.1002 / sca.4950100403 .
- ↑ a b c Inventor: Dr. Klaus Weber, Wetzlar, requerente Ernst Leitz GmbH: Dispositivo para varredura óptica de objetos microscópicos German Patent Office, Offenlegungsschrift 1472293 (online) , data de depósito 10 de agosto de 1966, data de publicação 23 de janeiro de 1969.
- ↑ a b Klaus Weber, Wetzlar, cedente a Ernst Leitz GmbH: Dispositivo para escanear opticamente o objeto em um microscópio. Patente U.S. 3518014 ( online no Google Patents ), depositada em 7 de agosto de 1967, emitida em 30 de junho de 1970.
- ↑ Barry R. Masters: Microscopy Confocal And Multiphoton Excitation Microscopy. The Genesis of Live Cell Imaging . SPIE Press, Bellingham, Washington, USA 2006, ISBN 978-0-8194-6118-6 , pp. 78-79 .
- ↑ RC Mellors, R. SILVER: Um scanner micro-fluorométrico para a detecção diferencial de células; aplicação de citologia esfoliativa. In: Science. Volume 114, Número 2962, outubro de 1951, pp. 356-360, ISSN 0036-8075 . PMID 14883859 .
- ↑ a b c d e f g Barry R. Masters: Microscopy Confocal And Multiphoton Excitation Microscopy. The Genesis of Live Cell Imaging . SPIE Press, Bellingham, Washington, USA 2006, ISBN 978-0-8194-6118-6 , pp. 88-96 .
- ↑ 11º encontro anual da European Light Microscopy Initiative (ELMI), 2011, Meeting's Program ( Memento de 31 de agosto de 2013 no Internet Archive )
- ↑ Plzeň 2015 seleciona Pilsner Ikonen 2012. In: bbkult.net. Centrum Bavaria Bohemia , acessado em 9 de fevereiro de 2016 .
- ^ A b P. Davidovits, MD Egger: Microscópio de varredura a laser. In: Nature. Volume 223, Número 5208, agosto de 1969, página 831, ISSN 0028-0836 . PMID 5799022 . doi: 10.1038 / 223831a0
- ↑ Barry R. Masters: Microscopy Confocal And Multiphoton Excitation Microscopy. The Genesis of Live Cell Imaging . SPIE Press, Bellingham, Washington, USA 2006, ISBN 978-0-8194-6118-6 , pp. 124-125 .
- ↑ a b c d e f Shinya Inoué: Fundamentos da Imagem Digitalizada Confocal em Microscopia de Luz . In: James Pawley (Ed.): Handbook of Biological Confocal Microscopy . 3ª Edição. Springer Science and Business Media LLC, 2006, ISBN 978-0-387-25921-5 , Capítulo 1, pp. 1-19 .
- ^ CJR Sheppard, A. Choudhury: Formação de imagem no microscópio de varredura. In: Optica Acta: International Journal of Optics. 24, 1977, pp. 1051-1073, doi: 10.1080 / 713819421 .
- ↑ C. Cremer, T. Cremer: Considerações sobre um microscópio de varredura a laser com alta resolução e profundidade de campo. In: Microscopica acta. Volume 81, Número 1, setembro de 1978, pp. 31-44, ISSN 0044-376X . PMID 713859 .
- ↑ FF Lucas: A ARQUITETURA DE CÉLULAS VIVAS-AVANÇOS RECENTES EM MÉTODOS DE PESQUISA BIOLÓGICA-SELECIONAMENTO ÓPTICO COM O MICROSCÓPIO ULTRA-VIOLETA. In: Proceedings of the National Academy of Sciences . Volume 16, número 9, setembro de 1930, pp. 599-607, ISSN 0027-8424 . PMID 16587612 . PMC 526698 (texto completo gratuito).
- ^ IJ Cox, CJ Sheppard: Microscópio óptico de varredura que incorpora um armazenamento de porta-retratos digital e microcomputador. In: Óptica aplicada. Volume 22, Número 10, maio de 1983, página 1474, ISSN 0003-6935 . PMID 18195988 .
- ↑ Brent Johnson: Imagem é tudo . In: The Scientist . 1 de fevereiro de 1999 ( online [acessado em 30 de novembro de 2012]).
- ^ Site da Heidelberg Instruments GmbH. Recuperado em 4 de junho de 2014 .
- ↑ Diana Morgan: Microscópios confocais ampliam os horizontes da carreira em biologia celular . In: The Scientist . 23 de julho de 1990 ( online [acessado em 30 de novembro de 2012]).
- ^ Albert Frosch, Hans Erdmann Korth: Método de aumentar a profundidade de foco. Patente U.S. 3.926.500. no Google Patents
- ↑ Gordon S. Kino, Guoqing Xiao: Microscópio óptico confocal de varredura incluindo um disco rotativo com aberturas angulares colocado entre um orifício e uma lente objetiva. Patente dos EUA 4.927.254, depositada em 29 de julho de 1988, emitida em 22 de maio de 1990 online no Google Patents
- ↑ Shinya Inoué: Fundamentos da Imagem Digitalizada Confocal em Microscopia de Luz . In: James Pawley (Ed.): Handbook of Biological Confocal Microscopy . 3ª Edição. Springer Science and Business Media LLC, 2006, ISBN 0-387-25921-X , Capítulo 1, pp. 1-19 .