Homocisteína
| Fórmula estrutural | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Fórmula estrutural de L- homocisteína | |||||||||||||||||||
| Em geral | |||||||||||||||||||
| Sobrenome | L homocisteína | ||||||||||||||||||
| outros nomes |
|
||||||||||||||||||
| Fórmula molecular | C 4 H 9 NO 2 S | ||||||||||||||||||
| Descrição breve |
cristais incolores |
||||||||||||||||||
| Identificadores / bancos de dados externos | |||||||||||||||||||
| |||||||||||||||||||
| propriedades | |||||||||||||||||||
| Massa molar | 135,18 g mol −1 | ||||||||||||||||||
| Estado físico |
firmemente |
||||||||||||||||||
| Ponto de fusão |
233 ° C (racemato) |
||||||||||||||||||
| instruções de segurança | |||||||||||||||||||
| |||||||||||||||||||
| Tanto quanto possível e usual, unidades SI são usadas. Salvo indicação em contrário, os dados fornecidos aplicam-se às condições padrão . | |||||||||||||||||||
L- homocisteína ( Hcy ) (pronunciado: homociste-ín) é um α- aminoácido de ocorrência natural, mas não proteinogênico. Éum produto intermediário da transferência de um carbonono metabolismo e é formado pela S - desmetilação da L - metionina como doador de metila. Valores elevados de homocisteína no sangue ( homocisteinemia ) podem danificar os vasos sanguíneos . Também está intimamente relacionado à depressão e demência na velhice . Os valores laboratoriais normais para exames de sangue estão entre 5 e 10 µmol·l −1 . Umsuprimento suficiente de betaína e vitaminas B 12 , B 6 e tetrahidrofolato de metila é necessáriopara regular o nível de homocisteína no sangue . A terapia com ácido fólico para prevenção de doenças é cientificamente controversa.
Duas moléculas de homocisteína podem se combinar para formar homocistina por meio de uma ponte dissulfeto . Quando o nível de homocisteína no sangue aumenta, a homocistina é excretada na urina ( homocistinúria ).
história
A homocisteína foi descoberta por Vincent du Vigneaud em 1932 enquanto trabalhava em compostos contendo enxofre. Mas foi só em 1962 que Carson e Neil reconheceram a ligação entre a homocisteína e certas doenças. Eles encontraram níveis significativamente aumentados de homocisteína na urina de um grupo de crianças com deficiência intelectual e postularam um defeito enzimático - homocistinúria clássica , causado por um defeito na cistationina β- transferase.
propriedades
Propriedades quimicas
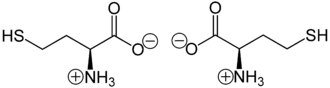
A homocisteína está presente principalmente como um “sal interno” ou ião dipolar , a formação da qual pode ser explicado pelo fato de que o protão dos carboxi grupo migra para o par solitário de electrões no átomo de azoto do grupo amino .
Zwitterions de L- homocisteína (esquerda) ou D- homocisteína (direita)
O zwitterion não migra no campo elétrico porque não está carregado como um todo. A rigor, esse é o caso no ponto isoelétrico (em um determinado valor de pH), no qual a homocisteína também apresenta sua menor solubilidade em água. Devido ao seu grupo CH 2 adicional em comparação com a cisteína , a homocisteína pode formar um anel heterocíclico de cinco membros , a chamada tiolactona . Esta reação de ciclização evita a formação de ligações peptídicas estáveis . Portanto, uma proteína que contém homocisteína tende a se decompor.
Significado bioquímico
O aminoácido L - metionina pode ser formado em uma remetilação a partir de L- homocisteína e metil FH 4 pela enzima metionina sintase . A metionina sintase requer vitamina B 12 como coenzima . Alternativamente, a homocisteína pode ser convertida em metionina no fígado e rins via betaína homocisteína metiltransferase . A coenzima para essa reação é a betaína. A homocisteína é decomposta através transsulfurization, um passo que é puramente vitamina B 6 dependente.
A L- metionina é usada bioquimicamente, por um lado, para a síntese de proteínas e, por outro lado, para a formação de S- adenosilmetionina (SAM). SAM é o doador mais importante para grupos metil no metabolismo celular. Uma vez que tenha abandonado seu grupo metil, S- adenosylhomocysteine (SAH) é formada, que é hidrolisada em adenosina e L- homocisteína:
A SAH inibe as reações de metilação, portanto sua degradação em homocisteína é absolutamente necessária para manter as reações de metilação. Se a degradação da homocisteína for perturbada, as importantes reações de metilação na célula também serão perturbadas.
Importância para a saúde
A homocisteína ocorre naturalmente no corpo humano. No entanto, valores elevados levam ao quadro clínico de hiper-homocisteinemia . Mesmo níveis moderadamente altos de homocisteína também podem aumentar o risco de doenças cardiovasculares . A redução dos níveis de homocisteína pode ter um efeito preventivo, mas não há estudos que apóiem isso.
Níveis elevados de homocisteína também estão associados a doenças oculares, particularmente retinopatia , síndrome de pseudoexfoliação , catarata , atrofia óptica e arteriosclerose dos vasos retinais; se há também uma conexão com a maculopatia é controverso.
No caso de deficiência de vitamina B12 , a homocisteína é aumentada e pode ser usada como um parâmetro de progressão para a terapia de uma deficiência de vitamina B12 (se a terapia for eficaz, os níveis aumentados de homocisteína devem normalizar novamente).
literatura
- Olaf Stanger: Homocisteína: Básico, Clínica, Terapia, Prevenção . Maudrich, Vienna / Munich / Bern 2004, ISBN 3-85175-766-1 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 5ª edição. Spectrum Academic Publishing House, Heidelberg 2003, ISBN 3-8274-1303-6 .
- Per Magne Ueland, Helga Refsum, Lars Brattström: 8. Plasma Homocysteine and Cardiovascular Disease . In: Robert Francis (Ed.): Doença cardiovascular aterosclerótica, hemostasia e função endotelial . M. Dekker, New York 1992, ISBN 0-8247-8726-9 , pp. 183–236 ( PDF 2,9 MB ( memento de 20 de novembro de 2004 no Internet Archive )).
- Wolfgang Herrmann, Rima Obeid: Vitaminas na prevenção de doenças humanas. 2011, ISBN 978-3-11-021448-2 .
- Wolfgang Herrmann, Rima Obeid: A fortificação obrigatória dos alimentos com ácido fólico: um tópico controverso na Alemanha. A fortificação obrigatória de alimentos básicos com ácido fólico: uma controvérsia atual na Alemanha. Artigo de revisão Ärzteblatt, doi: 10.3238 / arztebl.2011.0249
Evidência individual
- ↑ a b entrada na homocisteína. In: Römpp Online . Georg Thieme Verlag, acessado em 1 de junho de 2014.
- ↑ a b folha de dados DL-Homocisteína de Sigma-Aldrich , acessada em 5 de novembro de 2016 ( PDF ).
- ↑ Instituto Alemão de Pesquisa em Nutrição Potsdam-Rehbrücke: A combinação de baixos níveis de vitamina B12 e folato aumenta o risco de acidente vascular cerebral. Comunicado à imprensa de 25 de setembro de 2007, acessado em 9 de fevereiro de 2013.
- ↑ Cornelia Weikert et al: Níveis plasmáticos de vitamina B e o risco de acidente vascular cerebral isquêmico e ataque isquêmico transitório em uma coorte alemã. In: Stroke. 38, 2007, pp. 2912-2918. doi: 10.1161 / STROKEAHA.107.486068 .
- ↑ D. Gruson: Doenças cardiovasculares e homocisteína, um breve resumo de uma longa história. In: J Int Clin Chem. 14, 2003, p. 3.
- ↑ Vincent du Vigneaud: Uma Trilha de Pesquisa Sulfa: Da Insulina à Oxitocina. In: Nob Lec. 1955, pp. 1-10. (PDF)
- ^ NA Carson, DW Neill: Anormalidades metabólicas detectadas em uma pesquisa de indivíduos mentalmente atrasados na Irlanda do Norte . In: Arch. Dis. Filho. fita 37 , outubro de 1962, p. 505-513 , doi : 10.1136 / adc.37.195.505 , PMID 14018926 , PMC 2012909 (texto completo gratuito).
- ↑ HS Baernstein: In: Journal of Biological Chemistry. 106, 1934, página 451.
- ↑ P. Durand, M. Prost, N. Loreau: Impediu o metabolismo da homocisteína e doença aterotrombótica. In: Lab Invest . 81, 2001, pp. 645-672. PMID 11351038 .
- ^ Cruz Verde Alemã, acessado em 25 de novembro de 2015
- ↑ TA Ajith, Ranimenon: Homocisteína em doenças oculares . In: Clin. Chim. Acta . fita 450 , outubro de 2015, p. 316-21 , doi : 10.1016 / j.cca.2015.09.007 , PMID 26343924 .
- ↑ A. Pinna, F. Zaccheddu, F. Boscia, C. Carru, G. Solinas: Homocisteína e risco de degeneração macular relacionada à idade: Uma revisão sistemática e meta-análise . In: Acta Ophthalmol . fita 96 , no. 3 , maio de 2018, p. e269 - e276 , doi : 10.1111 / aos.13343 , PMID 27966830 .
- ^ S. Rajan, JI Wallace, SA Beresford, KI Brodkin, RA Allen, SP Stabler: Seleção para deficiência de cobalamina em pacientes ambulatoriais geriátricos: prevalência e influência da ingestão de cobalamina sintética. In: J Am Geriatr Soc. 50 (4), 2002, pp. 624-630. PMID 11982661 .
- ↑ Wolfgang Herrmann, Rima Obeid: Causas e diagnóstico precoce da deficiência de vitamina B12 . In: Deutsches Ärzteblatt . fita 105 , não. 40 , 2008, p. 680–685 , doi : 10.3238 / arztebl.2008.0680 ( online ).