Nucleação

Nucleação ou nucleação é o primeiro subprocesso que inicia uma transição de fase de primeira ordem. Exemplos disso são o congelamento de água em gelo, a formação de bolhas durante a transição da fase líquida para a fase gasosa (por exemplo, ao abrir uma garrafa de água com dióxido de carbono dissolvido ) ou a condensação de um gás.
Em geral
A característica essencial da nucleação é que a nova fase , que é termodinamicamente estável nas condições dadas , é inicialmente formada por núcleos da antiga fase metaestável . Um único núcleo é entendido aqui como uma área pequena e espacialmente homogênea da nova fase dentro da fase antiga, geralmente com apenas alguns nanômetros de tamanho .
A formação desses núcleos, que normalmente têm apenas nanômetros de tamanho, é inicialmente inibida cineticamente . Os líquidos podem ser super - resfriados e superaquecidos . A razão para esta inibição reside no trabalho que deve ser feito para formar a superfície curva de um minúsculo núcleo (por exemplo, uma gota esférica ) da nova fase. Para as menores gotículas ou cristais , esse trabalho de superfície é maior do que o ganho de energia da transição para a nova fase estável. A barreira de energia livre resultante é chamada de barreira de nucleação e o trabalho que deve ser feito para superar essa barreira é chamado de trabalho de nucleação (ver termodinâmica abaixo). A área do diagrama de fase em que os germes permanecem abaixo do tamanho crítico do germe é chamada de área de Ostwald-Miers .
No entanto, uma vez que núcleos maiores do que o tamanho crítico do núcleo são formados a partir de flutuações térmicas , eles crescem rapidamente para a fase macroscópica. A nucleação também pode ser entendida como um protótipo de um processo ativado .
A taxa de nucleação descreve quantos núcleos da nova fase são formados por unidade de volume e tempo. Esta taxa de nucleação depende exponencialmente do trabalho de nucleação: quanto maior o trabalho de nucleação e, portanto, a barreira à nucleação, menor a taxa (cf. cinética abaixo).
Ocorrer
A nucleação é um processo onipresente. Então aprende z. Por exemplo, a lava ejetada por um vulcão causa uma queda repentina de temperatura e pressão e, assim, forma as rochas típicas intercaladas com pequenas bolhas de gás. Outro exemplo são os fenômenos climáticos como a formação de chuva , nevoeiro e neve . Na medicina, conhece-se z. B. doença de mergulho causada por emergir muito rapidamente; Aqui, o nitrogênio previamente dissolvido no sangue por meio da queda de pressão foi liberado .
O conhecimento da cinética de nucleação também é de grande interesse para a indústria. B. para evitar a queda nas turbinas a gás ou o retardo de ebulição nos evaporadores ou para controlar a formação de rastros em aeronaves a jato . A nucleação também desempenha um papel central na engenharia do processo de polímeros , ligas e algumas cerâmicas , mas também no controle ou prevenção da cristalização (por exemplo, em materiais semicondutores , vidros metálicos ou mel ).
O eletrocongelamento é um processo pelo qual a cristalização de água e outros líquidos durante o processo de congelamento pode ser acionada de maneira direcionada pela aplicação de um campo elétrico . Este fenômeno físico é conhecido desde 1861.
Teoria de nucleação clássica
Devido à sua grande relevância técnica, os processos de nucleação têm sido sistematicamente investigados desde o início do século XX. Até agora, resultados substanciais estão disponíveis principalmente para a transição de fase de gás para líquido, cristalização e para a mudança estrutural em alguns metais. Na ausência de uma alternativa, as teorias apresentadas para isso são frequentemente transferidas para os sistemas restantes.
Devido à sua estrutura simples, a teoria clássica da nucleação prevaleceu até hoje , embora tenha sido repetidamente mostrado, especialmente para a transição gás-líquido, que suas previsões normalmente se desviam da realidade em várias ordens de magnitude (!). B. com argônio em mais de 20 ordens de magnitude. Essas grandes discrepâncias entre teoria e experimento são quase únicas na ciência contemporânea. Isso é ainda mais surpreendente porque é essencialmente um problema de física clássica .
A teoria clássica da nucleação faz algumas suposições básicas e simplistas que permitem uma descrição do processo. Uma grande parte dessas aproximações pode ser resumida sob o termo 'aproximação de capilaridade': Com essa aproximação, presume-se que mesmo os menores núcleos ( microscópicos ) já possuem as mesmas propriedades (macroscópicas) da nova fase.
Para ilustrar a teoria de nucleação clássica, o exemplo da condensação de uma gota de uma fase gasosa supersaturada é usado abaixo . Nesse caso, o processo geralmente é visto em temperatura constante e a força motriz é a supersaturação.
termodinâmica
No caso de uma fase gasosa supersaturada, a pressão atual é maior do que a pressão de vapor de equilíbrio a uma determinada temperatura :
O trabalho reversível que é necessário para formar uma gota de líquido dessa fase gasosa supersaturada, i. H. o trabalho de nucleação pode ser calculado. Para tanto, considera-se um processo com pressão constante, volume constante e número constante de partículas . O potencial termodinâmico relevante é, portanto, a energia livre de Gibbs :
com o potencial químico .
Especificamente para resultados de fase de vapor puro (índice v para vapor ):
- .
Para um sistema que contém vapor e uma gota de líquido (índice I para líquido ) feita de partículas, obtemos:
- ,
onde é a tensão superficial de uma gota com a superfície .
O trabalho de nucleação para uma gota de tamanho na fase gasosa é a diferença entre a energia livre de Gibbs de um sistema contendo uma gota de tamanho e vapor e aquela do sistema de vapor puro :
- .
Nesta equação está a diferença entre os potenciais químicos do vapor e do líquido.
A teoria de nucleação clássica faz uma série de suposições simplificadoras:
- A gota de líquido é esférica, incompressível e possui uma interface nítida .
- A gota de líquido tem a mesma tensão superficial, densidade e pressão de vapor que a fase líquida macroscópica (plana).
- A pressão de vapor pode ser descrita com a ajuda da lei dos gases ideais .
Com a ajuda dessas suposições e da equação de Gibbs-Duhem , a diferença nos potenciais químicos pode ser calculada:
- .
Com
- a constante de Boltzmann
- de supersaturação .
A superfície também pode ser calculada:
Com
- o raio da gota
- a área superficial média de uma partícula (molécula)
- o volume médio de uma partícula na fase líquida.
Isso resulta no trabalho de nucleação
- .
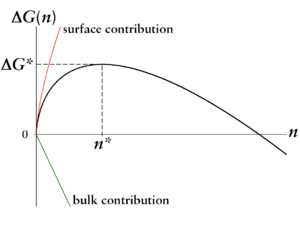
O primeiro termo, também chamado de termo de volume, é proporcional a . Ele representa o ganho (portanto, sinal negativo) em energia que ocorre quando uma molécula passa da fase de vapor metaestável para a fase líquida estável.
O segundo termo é o trabalho que deve ser feito (portanto, sinal positivo) para moldar a superfície de tal gota de líquido. Ele é proporcional a .
Com - somente neste caso pode ocorrer nucleação - o termo de superfície para pequenos números de partículas ou tamanhos de gotículas domina. De um tamanho de gota crítico , o termo de volume ganha vantagem. O máximo é o trabalho de nucleação que deve ser aplicado para formar uma gota de tamanho crítico. Isso dá a imagem mostrada de uma barreira na energia livre .
O tamanho crítico e o trabalho de nucleação crítica são os parâmetros determinantes da nucleação:
- Gotículas menores que têm maior probabilidade de evaporar novamente do que crescer ainda mais, pois para elas a evaporação está associada a um ganho de energia de Gibbs livre (movimento para baixo na curva).
- Apenas gotículas maiores do que têm maior probabilidade de crescer mais do que evaporar e podem, portanto, servir como sementes para a nova fase.
Portanto, é compreensível por que uma substância pode ser mantida metaestável por um longo tempo: Embora a nova fase (em nosso exemplo o líquido) seja a fase termodinamicamente estável, o processo deve primeiro passar por algumas etapas energeticamente desfavoráveis para escalar a barreira.
A barreira e o tamanho do núcleo crítico de acordo com a teoria de nucleação clássica são:
e
- .
cinética
A fim de calcular uma taxa de nucleação , ou seja, o número de núcleos formados por volume e tempo, a cinética de nucleação também deve ser considerada. A taxa de nucleação estacionária é geralmente calculada usando uma abordagem de Arrhenius :
O pré-fator é normalmente chamado de pré-fator cinético, mas não é discutido em detalhes aqui. Normalmente a altura da barreira tem uma influência muito maior e decisiva devido à dependência exponencial.
Tipos de nucleação
Nucleação homogênea
Se a nucleação ocorre no espaço livre, ou seja, através de um encontro estático das mesmas partículas, fala-se de nucleação homogênea.
Para isso é necessário que, no caso de condensação, um número suficiente de partículas lentas se juntem para formar estruturas maiores sem qualquer ajuda adicional. Partículas lentas podem surgir da colisão simultânea de mais de duas partículas ( colisão de três vias ). Uma partícula absorve grande parte da energia cinética e deixa duas partículas lentas para trás. A supersaturação é aproximadamente proporcional à probabilidade de tal colisão de três vias, que leva à nucleação. Dependendo do sistema em consideração, os sistemas termodinamicamente metaestáveis podem, portanto, permanecer neste estado por um longo tempo.
Nucleação heterogênea
Em contraste com a nucleação homogênea, apenas sobresaturações muito baixas de frequentemente menos de um por cento são necessárias com nucleação heterogênea. No caso da condensação, esta forma de condensação ocorre em superfícies já existentes (heterogêneas: em partículas de um tipo diferente ), ou seja, geralmente em partículas sólidas que flutuam na fase gasosa, os núcleos de condensação ou partículas de aerossol . Estes atuam como uma espécie de coletor de partículas em relação ao respectivo gás, com o raio e as propriedades químicas da partícula determinando essencialmente o quão bem as partículas de gás aderem a ela. Isso também se aplica analogamente a superfícies de corpos não particulados, caso em que se fala de uma conexão . Em ambos os casos, as partículas ou superfícies heterogêneas atuam como um catalisador de nucleação diminuindo significativamente a barreira de nucleação.
Veja também
Evidência individual
- ↑ M. Volmer e A. Weber: Formação de gotículas em vapores, Z. Phys. Chem. (Leipzig) Vol. 119, p. 227, 1926
- ↑ L. Farkas: Taxa de nucleação em vapores supersaturados, Zeitschr. f. física. Chemie, Vol. 125, p. 236, 1927 PDF
- ↑ R. Becker, W. Döring: Kinetic treatment of nucleation in supersaturated vapors, Ann. Phys. Vol. 24, p. 719, 1935, doi : 10.1002 / andp.19354160806
- ↑ D. Kashchiev, Butterworth-Heinemann (ed.): "Nucleation: Basic Theory With Applications", 2000, ISBN 0-7506-4682-9
- ↑ PG Debenedetti, Princeton University Press (Ed.): "Metastable Liquids: Concepts and Principles", 1996
- ↑ Alexander Fladerer, Reinhard Strey: Nucleação homogênea e crescimento de gotículas em vapor de argônio supersaturado: A câmara de pulso de nucleação criogênica. In: The Journal of Chemical Physics. 124, 2006, p. 164710, doi : 10.1063 / 1.2186327 .
- ↑ A. Fladerer: "Nucleação e crescimento de gotículas em vapor de argônio supersaturado: Construção de uma câmara de pulso de nucleação criogênica", Cuvillier-Verlag, Göttingen (2002), ISBN 3-89873-494-3 . PDF
Links da web
- The Extreme Diet Coke & Mentos Experiments (en) - Applied Nucleation