Óxido de titânio (IV)
| Estrutura de cristal | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Óxido de titânio (IV) no rutilo de modificação __ Ti 4+ __ O 2− | ||||||||||||||||||||||
| Em geral | ||||||||||||||||||||||
| Sobrenome | Óxido de titânio (IV) | |||||||||||||||||||||
| outros nomes | ||||||||||||||||||||||
| Fórmula de proporção | TiO 2 | |||||||||||||||||||||
| Descrição breve |
pó branco cristalino |
|||||||||||||||||||||
| Identificadores / bancos de dados externos | ||||||||||||||||||||||
| ||||||||||||||||||||||
| propriedades | ||||||||||||||||||||||
| Massa molar | 79,866 g mol −1 | |||||||||||||||||||||
| Estado físico |
fixo |
|||||||||||||||||||||
| densidade |
|
|||||||||||||||||||||
| Ponto de fusão |
1855 ° C |
|||||||||||||||||||||
| ponto de ebulição |
2900 ° C |
|||||||||||||||||||||
| solubilidade |
|
|||||||||||||||||||||
| Índice de refração |
opticamente anisotrópico , birrefringente ou biaxial |
|||||||||||||||||||||
| instruções de segurança | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Suíça: 3 mg m −3 (medido como poeira respirável ) |
|||||||||||||||||||||
| Dados toxicológicos |
> 5,5 mg l -1 ( LC 50 , crustáceos , 48 h ) |
|||||||||||||||||||||
| Tanto quanto possível e usual, unidades SI são usadas. Salvo indicação em contrário, os dados fornecidos aplicam-se às condições padrão . Índice de refração: linha Na-D , 20 ° C | ||||||||||||||||||||||
O óxido de titânio (IV) ( dióxido de titânio ) é o óxido de titânio com valor IV . Além desse óxido polimórfico , há vários subóxidos não estequiométricos de titânio, chamados de fases de Magneli, bem como óxido de titânio (III) e óxido de titânio (II) .
O dióxido de titânio tem uma ampla gama de utilizações como pigmento branco , razão pela qual quatro a cinco milhões de toneladas são produzidas em todo o mundo todos os anos. As principais áreas de aplicação são na área de revestimentos como lacas e tintas, seguidas de coloração de plásticos e papéis laminados. Os produtos coloridos geralmente também contêm pigmentos brancos para atingir um alto poder de cobertura .
O uso de dióxido de titânio como aditivo alimentar é controverso. Em maio de 2021, a Autoridade Europeia para a Segurança dos Alimentos (EFSA) declarou o uso da substância listada como E 171 como insegura. A França já havia proibido seu uso em alimentos em 2020; A Suíça também quer seguir o exemplo até o final de 2021.
história
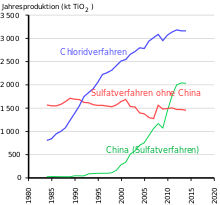
Depois que William Gregor descobriu o titânio na ilmenita em 1791 , Heinrich Klaproth reconheceu o dióxido de titânio no rutilo . O uso industrial começou quando sua excelente adequação como pigmento branco foi reconhecida na Noruega e nos EUA em 1908 . A partir de 1916, o pigmento foi produzido comercialmente com o nome de Kronos Titan White. Até 1938, o branco de titânio era produzido apenas na modificação do anatase , mas depois cada vez mais na modificação do rutilo, visto que sua atividade fotocatalítica é menor e a estabilidade dos produtos feitos a partir dele é correspondentemente maior. O pigmento branco baseado na modificação do rutilo também é conhecido como branco do rutilo.
Mais da metade do volume de produção é usado em tintas, seguido por polímeros e papel. Em 2014, 70% da produção mundial foi produzida por cinco fabricantes no mundo ocidental. Além da líder de mercado Chemours (EUA, anteriormente DuPont ), são as empresas Cristal Global (adquirida pela Tronox em 2019, Arábia Saudita), Tronox (EUA), Venator Materials (Reino Unido, antiga Huntsman , EUA) e Kronos (EUA). O maior fabricante da Ásia é LomonBillions (República Popular da China). De acordo com uma apresentação da Venator Materials em junho de 2018, os cinco maiores fabricantes ocidentais tinham 54% da capacidade de produção global. As regiões que mais consomem dióxido de titânio são Europa (1,72 milhão t), República Popular da China (1,42 milhão t), resto da Ásia (1 milhão t) e América do Norte (0,89 milhão t)).
Ocorrência
O óxido de titânio (IV) ocorre naturalmente em quatro modificações :
- O rutilo é um mineral tetragonal com hábito principalmente prismático . A estrutura cristalina está no grupo espacial 136, que corresponde ao símbolo P4 2 / mnm de Hermann Mauguin . O rutilo TiO 2 tem densidade de 4,26 g / cm 3 . O nome rutilo vem do latim rutilus 'avermelhado', aludindo à cor produzida pelas impurezas do ferro .
- O anatase forma cristais holoédricos tetragonais (holoédrico significa o grupo mais simétrico dentro de um sistema de cristais ) no tetragonal, portanto 4 / m 2 / m 2 / m . Ele se cristaliza no grupo espacial 141, ou seja, I4 1 / amd. O anatase se converte irreversivelmente em rutilo a 700 ° C, dependendo da atmosfera e dos íons estranhos. A densidade de anatase é 3,88 g / cm 3 .
- Brookita forma minerais ortorrômbicos e cristaliza no grupo espacial 61, Pbca. Brookita também muda para rutilo abaixo do ponto de fusão e tem uma densidade de 4,12 g / cm 3 . Tecnicamente, o brookite não tem significado.
- Riesita ( IMA 2015-110a ) é uma modificação de alta pressão que cristaliza no sistema de cristal monoclínico no grupo espacial P 2 / c (grupo espacial nº 13 ) e foi descoberta em 2015 por Oliver Tschauner e Chi Ma em Nördlinger Ries (Baviera, Baden-Württemberg).
Outras modificações
Além das modificações naturais, são conhecidas oito modificações produzidas sinteticamente, três das quais são metaestáveis (monoclínica, tetragonal e ortorrômbica) e cinco modificações de alta pressão (α-PbO 2 , baddeleita, cotunnita e estruturas ortorrômbicas e cúbicas). A modificação com uma estrutura cotunnita foi descrita por L. Dubrovinsky et al. como o óxido mais duro conhecido com uma dureza Vickers de 38 G Pa e um módulo de compressão de 431 GPa (para comparação: o diamante tem 442 GPa a 446 GPa) sob pressão normal. Estudos posteriores chegaram a resultados diferentes com valores mais baixos para a dureza (7–20 GPa, portanto mais macios do que óxidos como o corindo Al 2 O 3 e rutilo) e o módulo de compressão (≈ 300 GPa).
| modificação | Sistema de cristal | Manufatura |
|---|---|---|
| TiO 2 (B) | monoclínico | Hidrólise de K 2 Ti 4 O 9 com revenido subsequente |
| TiO 2 (H), forma de estrutura semelhante a hollandita | tetragonal | Oxidação do titanato de potássio bronze, K 0,25 TiO 2 |
| TiO 2 (R), estrutura semelhante a ramsadelite | ortorrômbico | Oxidação do titanato de lítio bronze Li 0,5 TiO 2 |
| TiO 2 (II) - ( estrutura semelhante a α-PbO 2 ) | ortorrômbico | |
| Estrutura semelhante a badeleita , (Ti coordenado de 7 vezes) | monoclínico | |
| TiO 2 -OI | ortorrômbico | |
| estrutura cúbica | cúbico | P > 40 GPa, T > 1600 ° C |
| TiO 2 -OII, estrutura semelhante a cotunnita ( PbCl 2 ) | ortorrômbico | P > 40 GPa, T > 700 ° C |
Extração e apresentação
O dióxido de titânio pode estar no laboratório por hidrólise de compostos de Ti (IV), como sulfato de titanil , tetracloreto de titânio , pois os alcoolatos de metal ou tetraisopropilato de titânio são preparados:
- Reação de sulfato de óxido de titânio com água para formar oxohidrato de titânio e ácido sulfúrico
- Reação de tetracloreto de titânio com água na primeira etapa para oxicloreto de titânio e ácido clorídrico e, em seguida, para oxohidrato de titânio e ácido clorídrico
- Tetraisopropóxido de titânio e água reagem para formar dióxido de titânio e isopropanol
Uma vez que os ésteres de ácido titânico dos n- alcanóis inferiores reagem com muita violência, o uso de ésteres de isopropanol ou terc- butanol é recomendado. O oxohidrato de titânio obtido desta forma, formalmente TiO (OH) 2 ou TiO 2 × H 2 O, é convertido em anatase ou rutilo por calcinação , com dióxido de titânio puro altamente recozido produzindo sempre a rede de rutilo. A combustão de cloreto de titânio (IV) com oxigênio raramente é usada em escala de laboratório. Dióxido de titânio muito puro pode ser produzido por hidrólise de TiCl 4 purificado .
Como a maior parte do TiO 2 produzido industrialmente é usado como pigmento, íons corantes, como o ferro, interferem . Ilmenita (FeTiO 3 ) ou escórias contendo titânio da eletrorredução da ilmenita são geralmente usadas como minérios para o processo de sulfato . Esta escória, assim como o rutilo de depósitos aluviais , também pode ser usada no processo de cloreto tecnicamente mais exigente . Ambos os processos aumentam significativamente a pureza do óxido de titânio. A soma dos íons corantes costuma ser inferior a 200 ppm no processo de sulfato, principalmente nióbio, subordinado ao ferro, e inferior a 50 ppm no processo de cloreto, nióbio e ferro.
Na produção industrial de óxido de titânio a partir da ilmenita pelo processo do sulfato, forma-se o ácido diluído (ácido sulfúrico diluído), que é em sua maioria reutilizado após concentração para a digestão da ilmenita . Em alguns países, este ácido diluído ainda é parcialmente descarregado em rios e mares ou despejado . Em contraste, a extração pelo processo de cloreto , principalmente de rutilo ou escória de TiO 2 , não permite a formação de ácido fino. O cloro usado permanece em grande parte no ciclo do processo. Os sais de ferro produzidos em ambos os processos são usados, entre outras coisas, para redução de cromato em cimentos, tratamento de águas residuais e em usinas de biogás.
Monocristais
Os monocristais de rutilo são geralmente feitos usando o processo Verneuil . O processo de fusão por zona também é ocasionalmente usado, enquanto o processo de Czochralski é descrito como inadequado.
Cristais únicos de Anatase não podem ser produzidos a partir do fundido. Aqui estão os métodos usados de CTR .
propriedades
Propriedades físicas
O ponto de fusão do dióxido de titânio é 1855 ° C, o composto é termicamente estável. O dióxido de titânio também é quimicamente inerte . É resistente à luz, barato e, portanto, o pigmento branco mais importante. É aprovado como aditivo E171 para alimentos.
Propriedades ópticas
O índice de refração do óxido de titânio é alto e mostra uma grande dispersão . O índice de refração também depende significativamente da modificação do cristal. O dióxido de titânio é birrefringente . A diferença no índice de refração entre um raio comum e um raio extraordinário pode atingir um valor de até .
Do ponto de vista colorístico , devido ao seu alto índice de refração, o dióxido de titânio possui o maior poder de cobertura de todos os pigmentos brancos e, ao mesmo tempo, excelente poder de clareamento . A cobertura máxima de dióxido de titânio está em um tamanho de grão de cerca de 200 nm a 300 nm, dependendo da aplicação e da distribuição de tamanho de referência, baseada em número ou baseada em massa.
O dióxido de titânio é um semicondutor , então a banda de valência é totalmente preenchida e a banda de condução desocupada na temperatura zero . O gap depende da modificação. Os quanta de luz com uma energia maior do que o gap são absorvidos. A luz ultravioleta também pode ser absorvida no comprimento de onda apropriado, criando assim proteção ultravioleta. A irradiação de luz de ondas curtas eleva os elétrons da banda de valência para a banda de condução e deixa um buraco . O tamanho do band gap depende da direção do cristal e, na área do material nanoparticulado , também do tamanho da partícula.
| modificação | Lacuna de banda (eV) | Comprimento de onda (nm) | índice de refração interpolado em 589 nm |
|---|---|---|---|
| Anatase | 3,23 | 385 | n e = 2,489 n o = 2,561 |
| Brookite | 3,14 | 395 | n α = 2,585 n β = 2,583 n γ = 2,702 |
| Rutilo | 3,02 | 410 | n e = 2,900 n o = 2,613 |
Propriedades dielétricas
O dióxido de titânio tem uma constante dielétrica comparativamente alta . Para rutilo, é ε = 111 na direção cristalográfica a e ε = 257 ao longo do eixo c. Outras fontes fornecem valores menores, em que os valores dependem dos parâmetros de medição, como frequência e temperatura. As aplicações são, por exemplo, dielétricos de alto k .
Propriedades quimicas
Dos óxidos de titânio, o dióxido de titânio (IV) é o composto mais comum. É quimicamente inerte e só pode ser dissolvido em ácido sulfúrico quente, ácido fluorídrico e álcalis quentes. É parcialmente o material de partida para a produção de titanatos . Quando iluminado com luz ultravioleta, podem ocorrer reações radicais fotocatalíticas .
usar
O dióxido de titânio é usado principalmente como pigmento branco e está listado no Índice de Cores sob CI Pigment White 6 ou CI 77891. É quimicamente estável e é utilizado com o rótulo E 171 como aditivo alimentar, por exemplo, como abrilhantador para pasta de dentes, goma de mascar, confeitaria, queijo ou molhos e como agente de separação (ver secção Riscos ). Os pigmentos de dióxido de titânio são usados como CI 77891 em cosméticos. Também é parcialmente usado em pinturas a óleo . Os campos técnicos de aplicação do dióxido de titânio, que representam cerca de 80 por cento do consumo total, incluem tintas e vernizes , plásticos e têxteis; Também é usado na produção de papel para atingir um alto grau de brancura e como bloqueador de UV em cremes solares e abrilhantadores em produtos farmacêuticos (comprimidos).
pigmento
O dióxido de titânio tem um índice de refração significativamente mais alto do que a maioria das substâncias orgânicas usadas para ligar cores. Isso significa que os pigmentos feitos de óxido de titânio espalham a luz de maneira eficaz, resultando em uma cor branca bem cobrida. O tamanho ideal dos pigmentos está na faixa de 200 nm a 300 nm. A faixa de tamanho resulta da teoria de Mie . O tamanho da partícula influencia a opacidade de um lado e o tom da cor do outro; os pigmentos finamente divididos aparecem mais azulados. Com uma participação de mercado de cerca de 60%, as aplicações mais importantes são materiais de revestimento e 25% de polímeros.
Além do E171, o dióxido de titânio puro raramente é usado, uma vez que, além do efeito protetor UV do TiO 2, ocorrem reações radicais químicas induzidas pela luz. A funcionalização dos grãos do pigmento reduz esse efeito e ao mesmo tempo melhora as propriedades da cor, geralmente por meio de uma dispersão mais fácil. Alguns aplicativos, por exemplo B. para aplicações de fibras ou cimento, use pigmentos anatase, apesar da maior atividade fotoquímica, enquanto a maioria das aplicações recai sobre pigmentos rutílicos.
Fotocatalisador
Muitos fabricantes oferecem fotocatalisadores baseados em TiO 2 . Normalmente são misturas de anatase, anatase-rutilo ou dióxido de titânio dopado com uma ampla gama de aplicações possíveis. Fotocatálise é uma catálise heterogênea na qual substâncias gasosas ou dissolvidas reagem sob luz ultravioleta por reação radical ou transferência de portador de carga para dióxido de titânio ou outras substâncias. Ao iluminar com luz ultravioleta, cuja energia é maior que o band gap, ou pela excitação menos eficiente das impurezas de um dopagem, portadores de carga livre, elétrons na banda de condução e buracos na banda de valência são gerados. Como regra, esses pares de portadores de carga se recombinam muito rapidamente, mas a curvatura da banda na área da superfície pode resultar na separação dos portadores de carga. Estes geralmente reagem com oxigênio e água adsorvidos para formar radicais hidroxila e peroxi. Como regra, exceto no caso de transferências diretas de carga para adsorbatos, os radicais reagem com substâncias orgânicas adsorvidas. As vias de reação para completar a mineralização podem ser muito complexas e requerem muitas excitações de fótons.
Para uso externo, autolimpante fotocatalítico como exemplo, o componente UV da luz solar ASTM 1.5 de cerca de 3% é geralmente usado , um máximo de cerca de 35 W / m 2 . As aplicações internas são geralmente menos favoráveis, por um lado o componente UV é muito baixo ou a taxa de reação é baixa no caso de catalisadores dopados. Os parâmetros na fotocatálise são rendimentos quânticos definidos de forma diferente . Valores típicos dificilmente podem ser dados porque um grande número de parâmetros vai para a catálise. Normalmente são mencionadas ordens de magnitude de 1 reação por 1000 fótons. Outro problema é que as reações fotocatalíticas não diferenciam entre a matriz do ligante orgânico e os poluentes. Sistemas de aglutinante inadequados, portanto, tendem a desbastar cedo .
Outros usos
Na produção de vidros ópticos especiais, o TiO 2 é usado para influenciar a dispersão óptica, o número de Abbe . O dióxido de titânio na modificação anatase é o principal componente dos catalisadores usados para a desnitrificação industrial de gases de combustão pelo processo SCR . A célula solar corante ( célula de Grätzel ) é baseada nas propriedades semicondutoras do dióxido de titânio . Com a ajuda de dióxido de titânio, os memristores foram feitos . O dióxido de titânio também é usado como o principal componente do dielétrico cerâmico em capacitores cerâmicos de classe 1 . Os monocristais de rutilo sintético são usados para prismas ópticos ou como imitações de diamante devido às suas propriedades ópticas . As imitações são fáceis de reconhecer devido à birrefringência. Além disso, o dióxido de titânio é usado para produzir aerossóis de teste .
prova
O dióxido de titânio recém-precipitado no frio é anfotérico e solúvel em ácidos minerais diluídos. A digestão ocorre com hidrogenossulfato de potássio em um cadinho de porcelana. Em seguida, é dissolvido em água fria com um pouco de ácido sulfúrico. Com algumas gotas de peróxido de hidrogênio, o cátion amarelo (básico) a amarelo-laranja (ácido, foto) [Ti (O 2 ) · aq] 2+ é formado.
Namorando
Em estratigráficas investigações sobre 115 anos de idade vienenses ferroviários ligeiros grades pintadas em torno de 15 vezes por Otto Wagner , a primeira aparição de branco rutilo foi usado para camadas de tinta data.
Riscos
O dióxido de titânio não é classificado como perigoso para a água .
Em junho de 2017, o Comitê de Avaliação de Risco (RAC) da ECHA avaliou a proposta de classificação da autoridade francesa, que propôs a classificação e rotulagem como "provavelmente cancerígena em humanos" (Carc 1B), e chegou à conclusão de que havia suspeita de dióxido de titânio ser cancerígeno se inalado deve ser classificado (Carc 2). Esta proposta de classificação teve de ser verificada pela Comissão Europeia e implementada na legislação aplicável.
Concentrações muito altas de nanopartículas , ou seja, partículas com menos de 100 nm, levam a reações imunológicas nos pulmões . A reação imune é discutida com a possibilidade de um risco de câncer baseado em inflamação, com TiO 2 nanoparticulado menor que 100 nm sendo testado e TiO 2 pigmentado maior que 200 nm sendo usado como um aplicativo de exemplo e para a quantidade de produção.
Em um grupo de 56 pessoas que foram escolhidas seletivamente por causa de problemas com implantes de titânio, 21 pessoas apresentaram uma reação positiva no teste MELISA ( teste de transformação de linfócitos) com TiO 2 , enquanto todas as 54 pessoas do grupo testaram usando o teste de patch , testaram negativo. Um estudo da Universidade da Carolina do Norte descobriu que as nanopartículas de dióxido de titânio eram tóxicas para as células cerebrais da microglia em camundongos.
Em testes de biólogos da Universidade de Koblenz-Landau com dáfnias (pulgas d'água), alguns efeitos significativos foram encontrados, apesar das baixas concentrações de dióxido de titânio na água: As concentrações usadas no teste foram de até 2 mg / le foram de até um fator de mais de 1000 acima da concentração suspeita no ambiente de ng / l a alguns µg / l. O efeito primário foi através do acúmulo de partículas na casca de quitina das pulgas d'água com consequências fatais no grupo de teste. A próxima geração de dáfnias também mostrou danos nos estudos por meio de um mecanismo de ação que não foi interpretado e analisado. Alguns desses estudos estão em contradição direta com um estudo mais antigo com concentrações significativamente mais altas de até 50 mg / l.
Em ratos, após 100 dias de administração oral de dióxido de titânio , o INRA administrou i.a. Inflamação intestinal observada. Segundo os autores, a dose de 10 mg / kg corresponde à quantidade a que o ser humano pode ser exposto pelo uso como corante alimentar E171. Outro estudo também mostra que a inflamação intestinal pode ser agravada pelo E171.
As investigações sobre a citotoxicidade de nanopartículas de dióxido de titânio fotocataliticamente ativas mostraram: nanopartículas feitas de dióxido de titânio podem formar radicais reativos ao absorver a radiação UV, que são capazes de quebrar muitas substâncias orgânicas. Esta propriedade tem inúmeras aplicações industriais, mas também traz o risco de efeitos nocivos para os organismos vivos.
Classificação como "provavelmente cancerígeno se inalado"
| instruções de segurança | ||||||||
|---|---|---|---|---|---|---|---|---|
| Sobrenome |
Misturas na forma de pó com um teor de pelo menos 1% de dióxido de titânio em forma de partícula ou incorporado em partículas com um diâmetro aerodinâmico ≤ 10 μm |
|||||||
| Número CAS | ||||||||
| Número CE |
236-675-5 |
|||||||
| ||||||||
| Dados toxicológicos |
> 5,5 mg l -1 ( LC 50 , crustáceos , 48 h ) |
|||||||
Em 2012, o óxido de titânio (IV) foi incluído no plano de ação em andamento da UE ( CoRAP ) de acordo com o Regulamento (CE) nº 1907/2006 (REACH) como parte da avaliação da substância . Os efeitos da substância na saúde humana ou no meio ambiente são reavaliados e, se necessário, são iniciadas medidas de acompanhamento. As causas da absorção de óxido de titânio (IV) foram preocupações com outras questões relacionadas a riscos, bem como os perigos suspeitos de propriedades carcinogênicas e o possível perigo de propriedades mutagênicas. A reavaliação teve início em 2018 e foi realizada pela França . Depois que o dióxido de titânio causou inflamação em experimentos com animais e pesquisadores suspeitaram de propriedades cancerígenas, a França decidiu em 2019 proibir seu uso em alimentos a partir de 2020.
Um perigo potencial para a saúde é visto principalmente na inalação de poeiras; este tem sido o assunto de inúmeras discussões. Em outubro de 2019, a Comissão da UE decidiu classificar e rotular o dióxido de titânio em pó com pelo menos 1% de partículas com um diâmetro aerodinâmico ≤ 10 μm como presumivelmente carcinogênico para humanos (Categoria 2) por inalação (H350 i). Em 18 de fevereiro de 2020, a classificação proposta de dióxido de titânio foi adotada como parte do 14º ATP (Adaptação ao progresso técnico) no Regulamento (UE) nº 2020/217 e, portanto, deve ser implementada até 1º de outubro de 2021.
Use como um aditivo alimentar
Em maio de 2021, a Autoridade Europeia para a Segurança dos Alimentos (EFSA) classificou o corante como não seguro para consumo humano, pois não poderia descartar um efeito negativo do dióxido de titânio no genoma humano . Na Suíça, onde os alimentos contendo dióxido de titânio tiveram que ostentar a nota nano na lista de ingredientes desde 1º de maio de 2021 , o E 171 será proibido como aditivo alimentar até o final de 2021, de acordo com o Federal Food Safety and Veterinary Escritório ; alguns fabricantes já dispensam voluntariamente o polêmico corante em alguns produtos.
Uso em medicamentos
Mais de 30.000 medicamentos contêm dióxido de titânio. Em maio de 2021, a Comissão da UE anunciou que pediria à Agência de Medicamentos da UE EMA para investigar se e como o dióxido de titânio pode ser reposto em medicamentos. De acordo com o Instituto Federal de Drogas e Dispositivos Médicos, quase um terço das “formas farmacêuticas orais sólidas” aprovadas na Alemanha contém dióxido de titânio.
Links da web
- Zusatzstoffe-online.de: Dióxido de titânio
Evidência individual
- ↑ Entrada em E 171: Dióxido de titânio no banco de dados europeu sobre aditivos alimentares, acessado em 16 de junho de 2020.
- ↑ Entrada sobre DIÓXIDO DE TITÂNIO no banco de dados CosIng da Comissão da UE, acessado em 5 de agosto de 2020.
- ↑ a b c d e f g h i Entrada sobre óxido de titânio (IV) no banco de dados de substâncias GESTIS do IFA , acessado em 19 de dezembro de 2019. (JavaScript necessário)
- ↑ a b Entrada no dióxido de titânio. In: Römpp Online . Georg Thieme Verlag, acessado em 1 de junho de 2014.
- ↑ a b T. Radhakrishnan: As propriedades ópticas do dióxido de titânio . In: Anais da Academia Indiana de Ciências - Secção A . fita 35 , não. 3 , 1952, pp. 117-125 , doi : 10.1007 / BF03172227 .
- ↑ Swiss Accident Insurance Fund (Suva): Valores limite - valores MAK e BAT atuais (pesquise por 13463-67-7 ou dióxido de titânio ), acessado em 2 de novembro de 2015.
- ↑ Univ. Química do roteiro da palestra em Freiburg , óxidos parte 4: Óxidos binários não estequiométricos.
- ↑ United States Geological Survey USGS TITANIUM MINERAL CONCENTRATES (PDF em inglês; 27 kB).
- ↑ a b EFSA: Dióxido de titânio: E171 já não é considerado seguro quando utilizado como aditivo alimentar. 6 de maio de 2021, acessado em 11 de maio de 2021 .
- ↑ a b Peter Fritsche: branqueador polêmico - a Suíça também proíbe o dióxido de titânio nos alimentos. Swiss Radio and Television (SRF), 11 de maio de 2021, acessado em 11 de maio de 2021 .
- ↑ T. Brock, M. Groteklaes, P. Mischke; Livro de tecnologia de pintura; 2ª edição; Rede Vincentz; Hanover; 2000; ISBN 3-87870-569-7 ; P. 123.
- ↑ https://www.icis.com/explore/resources/news/2018/07/19/10243097/tio2-players-in-major-asset-shuffle/
- ↑ Chemours: TiO2 Market Consumption (p. 9), Principais concorrentes e tecnologia (p. 13) , setembro de 2015 (data status 2014)
- ↑ a b c Cristal banco de dados estrutura do Center for Computational Materials Science ( Memento do originais desde 11 de abril de 2011, no Internet Archive ) Info: O arquivo de ligação foi inserido automaticamente e ainda não foi marcada. Verifique o link original e o arquivo de acordo com as instruções e, em seguida, remova este aviso. do Laboratório de Pesquisa Naval dos EUA .
- ↑ U. Hålenius, F. Hatert, M. Pasero, SJ Mills: IMA Commission on New Minerals, Nomenclature and Classification (CNMNC). Boletim 35 . In: Revista Mineralogical . fita 81 , nº 1 , fevereiro de 2017, p. 209-213 ( main.jp [PDF; 79 kB ; acessado em 19 de agosto de 2017]).
- ↑ a b LS Dubrovinsky, NA Dubrovinskaia, V Swamy, J Muscat, NM Harrison, R Ahuja, B Holm, B Johansson: Ciência dos materiais: O óxido mais duro conhecido . In: Nature . 410, No. 6829, 2001, pp. 653-654. doi : 10.1038 / 35070650 . PMID 11287944 .
- ↑ Oganov AR, Lyakhov AO: Rumo à teoria da dureza dos materiais . In: J. of Superhard Materials . 32, No. 3, 2010, pp. 143-147. doi : 10.3103 / S1063457610030019 .
- ↑ Y. Al-Khatatbeh, KKM Lee e B. Kiefer: Comportamento de alta pressão do TiO 2 conforme determinado pelo experimento e pela teoria . In: Phys. Rev. B . 79, No. 13, 2009, p. 134114. doi : 10.1103 / PhysRevB.79.134114 .
- ↑ Nishio-Hamane D., Shimizu A., Nakahira R., Niwa K., Sano-Furukawa A., Okada T., Yagi T., Kikegawa T.: A estabilidade e equação de estado para a fase cotunnita de TiO 2 até 70 GPa . In: Phys. Chem. Minerals . 37, No. 3, 2010, pp. 129-136. doi : 10.1007 / s00269-009-0316-0 .
- ↑ Marchand R., Brohan L., Tournoux M.: Uma nova forma de dióxido de titânio e o octatitanato de potássio K 2 Ti 8 O 17 . In: Boletim de Pesquisa de Materiais . 15, No. 8, 1980, pp. 1129-1133. doi : 10.1016 / 0025-5408 (80) 90076-8 .
- ↑ M. Latroche, L. Brohan, R. Marchand, M. Tournoux: Novos óxidos de hollandita: TiO 2 (H) e K 0,06 TiO 2 . In: Journal of Solid State Chemistry . 81, No. 1, 1989, pp. 78-82. doi : 10.1016 / 0022-4596 (89) 90204-1 .
- ↑ J. Akimoto, Y. Gotoh, Y. Oosawa, N. Nonose, T. Kumagai, K. Aoki, H. Takei: Topotactic Oxidation of Ramsdellite-Type Li 0,5 TiO 2 , a New Polymorph of Titanium Dioxide: TiO 2 ( R) . In: Journal of Solid State Chemistry . 113, No. 1, 1994, pp. 27-36. doi : 10.1006 / jssc.1994.1337 .
- ↑ PY Simons, F. Dachille: A estrutura do TiO 2 II, uma fase de alta pressão do TiO 2 . In: Acta Crystallographica . 23, No. 2, 1967, pp. 334-336. doi : 10.1107 / S0365110X67002713 .
- ↑ Sato H., Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K: Fase de alta pressão do tipo baddeleyite de TiO 2 . In: Science . 251, No. 4995, 1991, pp. 786-788. doi : 10.1126 / science.251.4995.786 . PMID 17775458 .
- ↑ Dubrovinskaia NA, Dubrovinsky L S., Ahuja R, Prokopenko V B., Dmitriev V., Weber H.-P., Osorio-Guillen JM, Johansson B: Identificação experimental e teórica de um novo polimorfo de TiO 2 de alta pressão . In: Phys. Rev. Lett. . 87, No. 27 Pt 1, 2001, página 275501. doi : 10.1103 / PhysRevLett.87.275501 . PMID 11800890 .
- ↑ Mattesini M, de Almeida JS, Dubrovinsky L., Dubrovinskaia L, Johansson B., Ahuja R.: Síntese de alta pressão e alta temperatura do polimorfo TiO 2 cúbico . In: Phys. Rev. B . 70, No. 21, 2004, página 212101. doi : 10.1103 / PhysRevB.70.212101 .
- ↑ a b c Georg Brauer (Ed.): Handbook of Preparative Inorganic Chemistry . 3., retrabalhado. Edição. fita II . Enke, Stuttgart 1978, ISBN 3-432-87813-3 , p. 1366 .
- ↑ C. Murty, R. Upadhyay, S. Asokan: Eletro Smelting of Ilmenite for Production of TiO 2 Slag. (PDF; 715 kB).
- ↑ Brochura da empresa Djeva sobre criação pelo método Verneuil (alemão, PDF de 4,2 MB).
- ↑ Kazuhito Hatta, Mikio Higuchi, Junichi Takahashi, Kohei Kodaira, "Floating zone growth and characterization of alumínio-doped rutile single Christianity", Journal of Crystal Growth, 163, 1996, pp. 279-284; doi: 10.1016 / 0022-0248 (95) 00972-8 .
- ↑ H. Machida e T. Fukuda: "Dificuldades encontradas durante o crescimento de Czochralski de cristais individuais de TiO 2 ", Journal of Crystal Growth, 112, 1991, pp. 835-837; doi: 10.1016 / 0022-0248 (91) 90142-R .
- ↑ T. Sekiya e S. Kurita, "Defects in Anatase Titanium Dioxide", Nano- and Micromaterials-Advances in Materials Research, 2008, Volume 9, pp. 121-141, doi : 10.1007 / 978-3-540-74557- 0_4 .
- ^ Polímeros, luz e a ciência de TiO 2 DuPont . (1,42 MB PDF).
- ↑ Erik Shepard Thiele: Espalhamento de radiação eletromagnética por microestruturas complexas no regime ressonante . 1998 ( PDF, 3,2 MB - Tese de Doutorado, Universidade da Pensilvânia).
- ↑ J. Winkler: Dióxido de titânio. Vincentz Network, Hannover 2003, ISBN 3-87870-738-X , p. 55.
- ↑ Michael Graetzel, Francois P. Rotzinger: a influência da estrutura da rede de cristal na energia da banda de condução de óxidos de titânio (IV) . In: Chemical Physics Letters . Vol. 118, No. 5, 1985, páginas 474-477.
- ↑ Bora Lee, Choong-ki Lee, Cheol Seong Hwang e Seungwu Han: Influência dos funcionais de correlação de troca nas propriedades dielétricas do rutilo TiO 2 , em: Current Applied Physics , Volume 11 (2011), S293-S296. doi: 10.1016 / j.cap.2010.11.104 .
- ↑ Rebecca A. Parker "Static Dielectric Constant of Rutile (TiO 2 ), 1,6-1060 ° K" , Phys. Rev. 124, 1961, pp. 1719-1722.
- ↑ Dióxido de titânio em alimentos . Titanium Dioxide Manufacturers Association (TDMA), acessado em 11 de maio de 2021.
- ↑ Ceresana: Estudo de Mercado de Dióxido de Titânio , acessado em 21 de maio de 2013.
- ↑ KRONOS Titan: Áreas de aplicação para TiO 2 (PDF; 374 kB).
- ↑ Sachtleben: Hombikat UV 100 .
- ↑ Evonik Aerosil, Aeroxid P25 ( Memento de 1 de julho de 2012 no Internet Archive ).
- ↑ KRONOS Titan: folha de dados Kronoclean (PDF; 488 kB).
- ↑ Neue Zürcher Zeitung: “Cobblestones against Smog” , artigo de visão geral, 16 de novembro de 2011.
- ↑ Fraunhofer Photocatalysis Alliance: “Medidas de eficiência biológica para fotocatalisador” (PDF; 79 kB).
- ↑ Tusnelda E. Doll: "Photoochemical and photocatalytic degradation of carbamazepine , clofibric , iomeprol and iopromid ", Dissertation, 2004, DNB 1002433525/34 .
- ↑ Martin Lindner: "Otimização da purificação fotocatalítica da água com dióxido de titânio: Estrutura sólida e superficial do fotocatalisador", dissertação, DNB 954460030/34 .
- ↑ Data center de recursos renováveis: Sunlight Spectrum ASTM 1.5 .
- ↑ Thorsten Ebbinghaus: "Degradação biológica-fotocatalítica combinada de compostos de nitrogênio ambientalmente relevantes para a limpeza de águas residuais agrícolas com filtros de plantas crescidos e TiO 2 / UV" , TU Dortmund, dissertação, 2003 (PDF; 1,5 MB).
- ↑ Martin Klare: "Possibilidades da degradação fotocatalítica de compostos de nitrogênio ambientalmente relevantes usando TiO 2 " , TU Dortmund, dissertação, 2003 (PDF; 3,3 MB).
- ↑ Kevin Bullis: Reconfigurando a Eletrônica . Revisão de tecnologia. 8 de maio de 2008, acessado em 25 de março de 2010.
- ↑ VDI 3491 folha 3: 2018-03 medição de partículas; Processo de fabricação de aerossóis de teste; Dispersão de pilhas e sólidos (Medição de partículas; Métodos de geração de aerossóis de teste; Dispersão de materiais sólidos). Beuth Verlag, Berlim. P. 7.
- ↑ Medição de partículas VDI 3491, folha 9: 1989-09 ; Produção de aerossóis de teste por meio de dispensador de escovas (Medição de material particulado; geração de aerossóis de teste com gerador de escovas rotativas). Beuth Verlag, Berlim. P. 5.
- ↑ Otto Wagner e o Verde dos anos 50: Sehgewohnheiten und Reality orf.at, 31 de dezembro de 2017, acessado em 31 de dezembro de 2017.
- ↑ Comunicado de imprensa da ECHA de 9 de junho de 2017
- ↑ nanopartikel.info: Nanocare , brochura, página 11 e seguintes (alemão, PDF; 2,7 MB).
- ↑ Yazdi, AS; Guarda, G.; Riteau, N.; Drexler, SK; Tardivel, A.; Couillin, I.; Tschopp, J. (2010). As nanopartículas ativam o domínio de pirina NLR contendo 3 (Nlrp3) inflamassoma e causam inflamação pulmonar através da liberação de IL-1 e IL-1 . Proceedings of the National Academy of Sciences 107 (45): pp. 19449-19454 doi: 10.1073 / pnas.1008155107 , PMC 2984140 (texto completo livre).
- ↑ Biodenth.be (PDF; 245 kB) K. Müller, E. Valentine-Thon: "Hipersensibilidade ao titânio: evidência clínica e laboratorial" ( Memento de 9 de novembro de 2013 no Arquivo da Internet ) Neuroendocrinology Letters, Vol. 27, Suppl . 1, 2006, pp. 31-35.
- ↑ TC Long, N. Saleh, RD Tilton, GV Lowry, B. Veronesi: Dióxido de titânio (P25) produz espécies reativas de oxigênio na microglia cerebral imortalizada (BV2): implicações para a neurotoxicidade das nanopartículas. In: Ciência e Tecnologia Ambiental . Volume 40, Número 14, julho de 2006, pp. 4346-4352. PMID 16903269 .
- ↑ Mirco Bundschuh, Frank Seitz, Ricki R. Rosenfeldt, Ralf Schulz, Elena A. Rozhkova: Nanopartículas de dióxido de titânio aumentam a sensibilidade na próxima geração da pulga d'água Daphnia magna. In: PLoS ONE. 7, 2012, p. E48956, doi: 10.1371 / journal.pone.0048956 .
- ↑ Volker Mrasek : deutschlandfunk.de: Influência mesmo através das gerações (22 de março de 2014).
- ↑ Nadja Podbregar: Consequências entre gerações : a nanopoluição de pequenos crustáceos torna seus descendentes excessivamente sensíveis. In: scinexx.de. 8 de março de 2013, acessado em 20 de agosto de 2019 .
- ↑ Kerstin Hund-Rinke, Markus Simon: Ecotoxic Effect of Photocatalytic Active Nanoparticles (TiO2) on Algae and Daphnids Ciência ambiental e pesquisa de poluição internacional: ESPR 13 (2006), No. 4, pp. 225-232, doi: 10.1065 / espr2006.06.311 .
- ↑ Bettini, S. et al.: O TiO2 de qualidade alimentar prejudica a homeostase imunológica intestinal e sistêmica, inicia lesões pré-neoplásicas e promove o desenvolvimento de criptas aberrantes no cólon do rato. Scientific Reports 7, Article number: 40373 (2017), doi: 10.1038 / srep40373 .
- ↑ Nanopartículas de dióxido de titânio podem aumentar a inflamação intestinal
- ↑ doi: 10.1136 / gutjnl-2015-310297
- ↑ C. Kasper, J. Z. Bloh, S. Wagner, D. W. Bahnemann, T. Scheper: Investigations on the cytotoxicity of photocatalytically active dióxido nanoparticles. In: Tecnologia de Engenheiro Químico. 82, 2010, p. 335, doi: 10.1002 / cite.200900057 .
- ↑ a b Entrada sobre óxido de titânio (IV) na forma de pó com pelo menos 1% de partículas com um diâmetro aerodinâmico ≤ 10 μm no banco de dados de substâncias GESTIS do IFA , acessado em 19 de dezembro de 2019. (JavaScript necessário)
- ↑ Entrada de dióxido de titânio no Inventário de Classificação e Rotulagem da Agência Europeia dos Produtos Químicos (ECHA), acessado em 7 de janeiro de 2021. Os fabricantes ou distribuidores podem expandir a classificação e rotulagem harmonizadas .
- ↑ Plano de ação evolutivo comunitário ( CoRAP ) da Agência Europeia dos Produtos Químicos (ECHA): Dióxido de titânio , acessado em 26 de março de 2019.
- ↑ A França proíbe o polêmico agente branqueador dióxido de titânio . Spiegel Online, 17 de abril de 2019.
- ↑ Regulamento (UE) 2020/217
- ↑ Dióxido de titânio: ainda há necessidade de pesquisas . Ministério Federal para Avaliação de Risco, 29 de julho de 2020.
- ↑ Segurança alimentar: a Comissão da UE propõe a proibição da aprovação do dióxido de titânio. In: tempo online . 6 de maio de 2021, acessado em 11 de maio de 2021 .
- ↑ Dióxido de titânio / Dióxido de titânio / CI 77891 | provável proibição. In: scriptorium. Obtido em 24 de maio de 2021 (alemão).
- ↑ Proibir nanopartículas prejudiciais à saúde como aditivos alimentares. In: parlament.ch . 2019, acessado em 28 de janeiro de 2021 .
- ↑ Peter Fritsche: Corante controverso - o dióxido de titânio desaparece de cada vez mais produtos. Swiss Radio and Television (SRF), 26 de abril de 2021, acessado em 26 de abril de 2021 .
- ↑ Jost Maurin / taz.de 30 de maio de 2021: Corante inseguro em comprimidos










