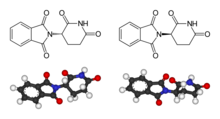
Talidomida
| Fórmula estrutural | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Fórmula estrutural simplificada sem estereoquímica | |||||||||||||||||||
| Em geral | |||||||||||||||||||
| Nome não proprietário | Talidomida | ||||||||||||||||||
| outros nomes |
|
||||||||||||||||||
| Fórmula molecular | C 13 H 10 N 2 O 4 | ||||||||||||||||||
| Descrição breve |
sólido incolor |
||||||||||||||||||
| Identificadores / bancos de dados externos | |||||||||||||||||||
| |||||||||||||||||||
| Informação sobre drogas | |||||||||||||||||||
| Código ATC | |||||||||||||||||||
| Aula de drogas | |||||||||||||||||||
| propriedades | |||||||||||||||||||
| Massa molar | 258,23 g · mol -1 | ||||||||||||||||||
| Estado físico |
fixo |
||||||||||||||||||
| Ponto de fusão |
270 ° C |
||||||||||||||||||
| solubilidade |
praticamente insolúvel em água (45-60 mg · l -1 a 25 ° C) |
||||||||||||||||||
| instruções de segurança | |||||||||||||||||||
| |||||||||||||||||||
| Tanto quanto possível e usual, unidades SI são usadas. Salvo indicação em contrário, os dados fornecidos aplicam-se às condições padrão . | |||||||||||||||||||
A talidomida (α-ftalimidoglutarimida) é uma droga desenvolvida em 1954 que foi vendida como um sedativo e adormecido sob as marcas Contergan e Softenon e causou vários danos graves à vida por nascer ( dismelia, etc.) no final dos anos 1950 / início dos anos 1960 levou a o escândalo da talidomida . Quimicamente falando, como a glutetimida , o metiprilon e a piritildiona , pertence ao grupo das piperidinedionas , uma modificação estrutural dos barbitúricos . Além do efeito de promoção do sono, o ingrediente ativo também tem propriedades antitumorais, antiinflamatórias e anti-formação de vasos sanguíneos. Desde 1998, a talidomida tem sido usada nos EUA para o tratamento de formas particularmente graves de hanseníase e, desde 2009, na Alemanha, para o tratamento de mieloma múltiplo, sujeito a rígidos requisitos de segurança; é oferecido como genérico pela empresa Celgene .
história
Medicação para dormir e sedativo
Em março de 1954, no departamento de pesquisa da empresa farmacêutica Stolberg Grünenthal - procurando um método barato para obter antibióticos a partir de peptídeos e como parte do desenvolvimento de novos comprimidos para dormir, como piritildiona ( persedon ) e glutetimida - aquecendo a ftaloilisoglutamina de Heinrich Mückter , Wilhelm Kunz (nascido em 1920) e Herbert Keller (nascido em 1925) sintetizaram a ftalimidoglutarimida. Foi chamada de talidomida pelo chefe do departamento de pesquisa, Mückter, e em dezembro de 1960 respondia por quase metade das vendas domésticas de Grünenthal.
Os resultados da pesquisa de Grünenthal não produziram nenhuma reação patogênica ou outros resultados positivos que pudessem ser usados na medicina para a talidomida em camundongos e ratos (não grávidas). O ingrediente ativo parecia, portanto, inofensivo para Grünenthal. Além disso, altas doses não mostraram nenhum efeito letal em ratos, camundongos, porquinhos-da-índia, coelhos, gatos e cães, e nenhum outro efeito colateral foi encontrado em Grünenthal. A talidomida foi, portanto, classificada como “não tóxica”, o que é muito atraente para avaliação comercial. O composto patenteado começou a ser usado. A talidomida não se mostrou inicialmente um sedativo em experimentos com animais . Como um sedativo não letal teria grande potencial de mercado, a empresa decidiu intensificar as pesquisas na direção de um sonífero humano.
Inicialmente, foi prescrito para a profilaxia de convulsões na epilepsia . Não apresentou efeito anticonvulsivante , mas os pacientes relataram as boas propriedades indutoras e relaxantes do sono da droga.
A talidomida não foi autorizada a ser vendida na Alemanha até que sua eficácia fosse testada em experimentos com animais. Uma vez que a talidomida não mostrou nenhum efeito sedativo em experimentos com animais, ela foi testada em camundongos em gaiolas agitadoras . Foi investigado em que medida os movimentos dos camundongos no grupo verum (grupo que recebeu o ingrediente ativo) e no grupo placebo diferiram.
Antes de o medicamento chegar ao mercado, um funcionário da Grünenthal levou uma amostra para casa e deu à esposa grávida para ajudá-la a dormir melhor. A criança nasceu sem orelhas e assim se tornou a primeira vítima de Contergan.
Grünenthal comercializou a substância de 1 ° de outubro de 1957 a novembro de 1961 sob o nome de Contergan como "a primeira droga sedativa e para dormir sem bromo sem grandes efeitos colaterais ". Visto que a talidomida, entre outras coisas, contra o enjoo matinal típico ajudou nos primeiros estágios da gravidez, foi especificamente no final da década de 1950 do que os sedativos e pílulas para dormir recomendados para mulheres grávidas e anunciados. Quanto aos efeitos colaterais, foi considerado particularmente seguro, pois, como sonífero sem bromo , deve-se evitar efeitos colaterais como confusão mental, delírio e gagueira. Além disso, era significativamente menos perigoso do que os barbitúricos frequentemente usados em suicídios. A talidomida também estava contida nos medicamentos Algosediv , Grippex e, como um componente fornecido pela Grünenthal, no medicamento para tosse Peracon, da Kali Chemie .
Escândalo Contergan
No final da década de 1950, havia um acúmulo de malformações inicialmente inexplicável nos recém-nascidos. Publicamente e no Ministério Federal da Saúde da Alemanha , recentemente instituído , havia a suspeita de possíveis danos causados pela energia nuclear e, em particular, pelos testes de armas nucleares que eram realizados na época na superfície . O índice de malformações em crianças foi examinado e um aumento foi negado estatisticamente, mas com dados que só alcançaram o momento em que a talidomida foi aprovada para o mercado. Com base nessas estatísticas, acreditava-se que o dano ocorrido recentemente era apenas um acúmulo coincidente, o que atrasou significativamente a investigação da causa.
Os efeitos teratogênicos da droga talidomida foram descobertos independentemente na Alemanha e na Austrália. O médico australiano William McBride publicou em 16 de dezembro de 1961 uma carta ao editor sobre malformações em recém-nascidos em conexão com a administração de talidomida no The Lancet . Ele já havia entrado em contato com o licenciado na Austrália, que encaminhou o alerta ao fabricante alemão Grünenthal em novembro de 1961. Pouco antes, em 15 de novembro de 1961, o geneticista humano Widukind Lenz havia informado a empresa de suas suspeitas. Em 18 de novembro, ele relatou suas suspeitas em uma conferência de especialistas. A empresa Grünenthal inicialmente reagiu com uma resposta de esperar para ver. Embora a empresa manufatureira com sede em Stolberg tenha recebido 1.600 avisos sobre malformações observadas em recém-nascidos em 1961, a talidomida ainda era vendida. Somente depois que um artigo de jornal publicou as suspeitas de Lenz no Die Welt am Sonntag em 26 de novembro de 1961, Grünenthal finalmente retirou Contergan do mercado no dia seguinte .
De acordo com a Associação Federal de Vítimas da Talidomida , nasceram cerca de 5.000 crianças com a doença da talidomida. Outras fontes falam de 10.000 casos em todo o mundo, dos quais 4.000 ocorreram na República Federal da Alemanha , dos quais metade já havia morrido (em 2007). Também há um número desconhecido de abortos espontâneos. Na RDA , o Comitê Consultivo Central para Produtos Farmacêuticos rejeitou a fabricação e venda de pílulas para dormir com base na talidomida, pois isso foi classificado como ainda não verificado de forma adequada. Alguns pacotes de talidomida vieram da República Federal para a RDA. Um total de 8 casos de malformações causadas por Contergan foram documentados na RDA.
Na Áustria e na Suíça, o remédio era chamado de Softenon e só estava disponível mediante receita médica . Oficialmente, existem 13 vítimas da talidomida na Áustria, porque naquela época a exigência de prescrição era muito restritiva lá. Nove crianças afetadas por Contergan nasceram na Suíça. Softenon foi retirado do mercado em 1962.
Também há casos reconhecidos de danos da talidomida no Brasil . Contergan também foi entregue em grandes quantidades para a Europa Oriental e Oriente Médio.
Nos EUA , a aprovação da talidomida foi recusada, mas foi distribuída em grandes quantidades "para fins de teste" depois que o fabricante americano Richardson-Merrell solicitou a aprovação pela primeira vez em setembro de 1960. Frances Oldham Kelsey , a farmacologista responsável pela Food and Drug Administration dos EUA , não se baseou nas informações de Richardson-Merrell, que não incluíam os resultados dos testes. Em vez disso, apenas declarações gerais de Grünenthal e do departamento de marketing da Richardson-Merrell foram feitas, e empresários e políticos pressionaram Kelsey. Ela pediu a Richardson-Merrell para fazer testes e relatar os resultados. A empresa recusou e pediu seis vezes no total para permitir a aprovação, que foi recusada todas as vezes. Em 1962, Richardson-Merrell retirou o pedido de aprovação. No entanto, um total de 17 crianças nasceram com deformidades relacionadas à talidomida.
A presença concentrada da mídia no tema, gerada pelo 50º aniversário do lançamento de Contergan no mercado e pelo programa de televisão em duas partes Contergan, que foi transmitido logo em seguida , levou às primeiras conversas entre Grünenthal e a Associação Federal em 7 de dezembro , 2007 - 46 anos após o efeito danoso se tornar conhecido as vítimas da talidomida. Outras partes feridas também estão pedindo um diálogo e iniciaram uma campanha de assinaturas online com base na citação do produtor do filme de duas partes. Como resultado, as associações afetadas também esperam melhorias financeiras e outras melhorias em sua situação. Em 1º de julho de 2008, foi implementada a duplicação das remunerações mensais. Políticos e associações descrevem isso como o “primeiro passo importante” para mitigar os “efeitos financeiros de danos tardios e consequentes”. Em 8 de maio de 2008, Grünenthal anunciou que pagaria voluntariamente 50 milhões de euros à Fundação Contergan para melhorar permanentemente as condições de vida das vítimas de Contergan. Isso foi implementado em 15 de julho de 2009.
Danos por talidomida
A talidomida, tomada nos primeiros três meses de gravidez , leva a malformações graves dos membros ( dismelia , como a mão torácica radial ), especialmente à ausência de ossos longos ( focomelia ), ou mesmo à ausência total ( aplasia ) de membros e órgãos em crianças. A talidomida bloqueia o fator de crescimento VEGF (Fator de crescimento endotelial vascular), que leva à falta de vascularização (formação de vasos sanguíneos) nas extremidades do embrião. Isso leva a um contato encurtado ou ausente dos braços e pernas, principalmente em ambos os lados. Isso deve ser diferenciado de uma constrição mecânica dos membros (veja a síndrome do ligamento amniótico ).
A proteína cereblon , que forma um complexo ubiquitina-ligase com outras proteínas, foi identificada como um alvo teratogênico direto . Este complexo também controla a morfogênese do membro, e a inibição da atividade da ligase pela ligação da talidomida ao cereblon é a principal causa biológica de malformações. Esse mecanismo ficou conhecido em 2010.
Em 2018, foi publicado que a talidomida e as drogas semelhantes lenalidomida e pomalidomida quebram vários fatores de transcrição , incluindo todos os três SALL4 ("proteína semelhante ao Sal 4"), que são necessários para o crescimento. Enquanto na síndrome de Okihiro , na qual podem ocorrer malformações muito semelhantes, a falha do SALL4 é baseada em sua mutação genética, essas drogas não levam a uma mutação. Além dos humanos, essa falha afeta apenas algumas espécies animais (primatas e coelhos); em outras, como camundongos, SALL4 não é degradado pelo Cereblon devido a diferenças genéticas, razão pela qual o efeito teratogênico não foi reconhecido nos experimentos habituais com animais no momento.
No caso da embriopatia da talidomida, foi particularmente bem investigado em que ponto no tempo em que a droga é exposta a quais danos: por exemplo, se a droga for tomada entre o 34º e 37º dia após o último período menstrual, a aurícula é faltando, entre o 35º e 35º dia e 41º dias, a um subdesenvolvimento do polegar, entre as malformações de braço do 38º e 45º dias, entre as malformações de perna do 41º e 47º dias e entre as malformações do polegar do 46º e 50º dias.
No período posterior a 1961, após a retirada do Contergan do mercado, ele continuou a ser testado em várias espécies animais . Os resultados foram em sua maioria negativos ou não mostraram malformações comparáveis na prole. Embora ratos e camundongos tenham sido sedados pela substância (a razão pela qual o efeito sedativo da talidomida foi descoberto, foi em um experimento em que um efeito completamente diferente da substância ativa foi investigado, os roedores receberam a talidomida, adormeceu inesperadamente), nenhum efeito teratogênico claro da preparação pôde ser demonstrado, mesmo em experimentos clássicos com animais com altas concentrações. Foi só em 1962 que os Brancos da Nova Zelândia - uma raça de coelhos que não era comumente usada como modelo animal como animal de teste antes do lançamento no mercado - mostraram um efeito teratogênico . Esta especificidade de espécie de um efeito teratogênico, que foi comprovado desta forma, era anteriormente desconhecida e representava uma falta de transferibilidade dos resultados dos testes em animais para humanos.
O medo de que a talidomida também pudesse prejudicar as gerações subsequentes , alterando a composição genética , não se tornou realidade. Os filhos de pessoas afetadas pela talidomida não são afetados pela síndrome da talidomida.
Uma polineuropatia pode se desenvolver no próprio paciente consumidor , que é o fator limitador de dose mais importante nas novas indicações . Pode regredir rápida e completamente, mas também pode persistir por anos. Além disso, um risco aumentado de degeneração maligna está sendo examinado mais de perto; o fabricante já havia publicado uma carta em vermelho em 2013 .
Em mais de 2.000 relatórios de pesquisa, os resultados de estudos que buscaram compreender o mecanismo molecular do dano fetal desde 1961 foram registrados, e mais de trinta hipóteses para explicar o dano foram apresentadas.
Diferentes efeitos de ( S ) - e ( R ) -enantiômero

A talidomida é um composto quiral vendido como um racemato . O efeito sedativo é atribuído ao (+) - ( R ) - enantiómero , o efeito teratogénico é atribuído ao (-) - ( S ) -enantiómero. Por deuteração do estereocentro, os análogos da talidomida podem ser estabilizados com sucesso estereoquimicamente.
Farmacocinética
A talidomida é pouco solúvel no trato gastrointestinal e, portanto, a absorção após a ingestão oral em humanos é lenta e extensa. Com uma dose de 200 mg, um pico de concentração sérica de 1–2 mg / L é alcançado após 3 a 4 horas. A meia-vida de eliminação é de cerca de 6 horas, o que, como a eliminação é rápida, reflete aproximadamente as taxas de absorção. A talidomida dificilmente é metabolizada pelo fígado. No entanto, suas ligações amida são clivadas por hidrólise . A hidroxilação dos anéis moleculares da talidomida é dependente da espécie e de pouca importância em humanos.
Os dois enantiômeros se convertem um no outro no corpo humano com meia-vida de 2 a 6 horas - eles racemizam. Uma vez que o ( S ) -enantiômero é excretado muito mais rápido do que sua contraparte configurada ( R ) , uma saliência de equilíbrio permanece no sangue neste último.
síntese
A primeira variante de síntese de Grünenthal é baseada em anidrido ftálico , que é convertido em piridina com L - ácido glutâmico na primeira etapa . O intermediário de ácido dicarboxílico resultante é então ciclizado para o anidrido na presença de anidrido acético . O composto alvo então resulta de uma reação com a ureia . Esta sequência de síntese resulta em um racemato .
Novas indicações
Em estudos clínicos, a talidomida demonstrou efeitos terapêuticos em várias doenças devido à sua eficácia antiinflamatória (antiinflamatória), antineoplásica (inibidora de tumor) e antiangiogênica (redução da formação de novos vasos sanguíneos). Isso inclui doenças de pele ( eritema nodoso hansênico , lúpus eritematoso ), mieloma múltiplo e doenças autoimunes . Quando usado corretamente, o ingrediente ativo foi, portanto, classificado como uma terapia útil para pacientes cujas doenças não existe outro tratamento adequado. Também tem sido usado com sucesso no tratamento de aftas em pacientes com HIV .
Em pacientes com câncer de próstata submetidos a bloqueio hormonal intermitente , a administração de talidomida resultou em um aumento no tempo necessário para o nível de PSA subir novamente (como um sinal de que o câncer estava se reativando).
lepra
Em 1964, o dermatologista israelense Jacob Sheskin, que administrou Contergan a partir de estoques residuais a um paciente com hanseníase , descobriu que suas úlceras haviam diminuído significativamente no dia seguinte. Como resultado dessa descoberta, a talidomida foi testada para essa indicação, principalmente em países da América do Sul , como Colômbia e Brasil .
No entanto, o medicamento também foi administrado a mulheres grávidas, e as malformações voltaram a ocorrer nos recém-nascidos. Como a taxa de analfabetismo é alta em alguns segmentos da população no Brasil, muitas mulheres interpretaram mal o rótulo com uma gestante riscada na embalagem como uma pílula anticoncepcional . Isso resultou em uma nova geração de crianças gravemente malformadas no Brasil. Como resultado, o Brasil inicialmente proibiu a liberação da talidomida para pessoas em idade reprodutiva. No Brasil, há um total de 480 casos reconhecidos de danos da talidomida. Hoje, a talidomida se estabeleceu como o medicamento padrão para hanseníase no Brasil; é considerado o remédio mais eficaz para a doença.
Em 1998, a Food and Drug Administration dos EUA aprovou um pedido de aprovação de um medicamento contendo talidomida para o tratamento do eritema nodoso hansênico (ENL), uma forma particularmente grave de hanseníase. O titular da Autorização de Introdução no Mercado, Celgene , deve garantir precauções de segurança estritas durante a terapia. O paciente que participa deve aceitar e cumprir condições estritas.
Mieloma múltiplo
A indicação agora foi expandida para incluir o tratamento do mieloma múltiplo . Depois que a talidomida já havia sido designada como uma chamada "droga para doenças raras" ( medicamento órfão ) em 2001 e inscrita como tal no registro comunitário da UE correspondente, a Comissão da UE concedeu a aprovação para uma forma de dosagem oral (cápsulas de 50 mg) para em abril de 2008 Terapia combinada com melfalano e prednisona em pacientes com mielomas múltiplos não tratados anteriormente com 65 anos ou mais ou em pacientes para os quais a quimioterapia em altas doses não pode ser considerada (titular da autorização de introdução no mercado: Pharmion Ltd.).
Em 2019, uma revisão da Cochrane foi publicada sobre os benefícios e malefícios de algumas terapias de combinação de medicamentos para o tratamento primário do mieloma múltiplo. Esta forma de terapia é usada em pacientes que não são elegíveis para um transplante de células-tronco . Uma combinação de drogas com a talidomida fazia parte do artigo de revisão. É provável que esta combinação de talidomida, melfalano e prednisolona cause um aumento na sobrevida global em comparação com a terapia com melfalano e prednisolona isoladamente. A talidomida associada ao melfalano e prednisolona pode causar um aumento acentuado na sobrevida livre de progressão. A administração de talidomida associada a melfalano e prednisolona provavelmente leva a um aumento acentuado das polineuropatias. A talidomida associada ao melfalano e prednisona causou um aumento acentuado na descontinuação do paciente devido a eventos adversos. Mais pesquisas são necessárias para avaliar a segurança, eficácia e impacto na qualidade de vida dessa forma de terapia.
Síndrome mielodisplásica
A administração de talidomida para o tratamento da síndrome mielodisplásica está sendo examinada em estudos multicêntricos. Um mecanismo de ação preciso ainda não é conhecido, mas pode ser a inibição do fator de necrose tumoral (TNF-α) e a estimulação de células T citotóxicas . Dados preliminares mostram que a talidomida pode melhorar a contagem de células do sangue periférico em muitos pacientes. Alguns pacientes alcançam a normalização completa do hemograma.
Doença de crohn
Graças ao seu forte efeito imunomodulador , a talidomida também foi capaz de mostrar efeitos no tratamento de crianças e adolescentes com doença de Crohn que não responderam aos medicamentos anteriores. Como imunossupressor , o ingrediente ativo foi capaz de atingir remissão duradoura em vários pacientes .
distribuição
Além dos EUA (desde 1998), a talidomida está atualmente na Austrália (desde outubro de 2003), Nova Zelândia (desde dezembro de 2003), Turquia (desde junho de 2004), Israel (desde setembro de 2004) e nos estados membros da UE (desde Abril de 2008) autorizado. Nos EUA, China, Japão, Coréia e Taiwan, a talidomida é vendida pela Celgene. Isso também produz lenalidomida, que é semelhante à talidomida . A empresa britânica Pharmion adquiriu os direitos de marketing da Celgene para todos os outros países . No início de 2008, entretanto, a Celgene adquiriu a Pharmion com todo o seu portfólio de produtos. Produtos anteriormente licenciados, como B. A talidomida agora será administrada exclusivamente pela Celgene novamente. A aplicação ocorre sob rígidas diretrizes de segurança.
Na Alemanha, a dispensa de medicamentos contendo talidomida é regulamentada pela Seção 3a da Portaria de Prescrição de Medicamentos e está sujeita a monitoramento oficial. Portanto, o médico tem que usar a chamada prescrição T para a prescrição . Apenas uma preparação pode ser prescrita por prescrição T. O médico deve garantir que as medidas de segurança de acordo com a informação do medicamento atual são observadas, em particular que um programa de prevenção da gravidez é executado, se necessário. Deve também anotar na receita se o tratamento ocorre dentro ou fora (uso off-label ) das respectivas áreas de aplicação aprovadas. Os medicamentos que contêm talidomida ou lenalidomida não podem ser colocados no mercado por encomenda postal (Secção 17, Parágrafo 2b do Regulamento Comercial das Farmácias ).
A empresa Chemie Grünenthal GmbH , que já produzia o Contergan, doou o restante do produto aos cientistas até o final de 2003. A empresa, que agora tem sede em Aachen , não vende mais a talidomida.
Veja também
- Contergan (filme) , implementação cinematográfica de 2006
- Fundação Contergan para pessoas com deficiência
literatura
- K. Roth: Uma história química sem fim. Em: Chemistry in Our Time , Volume 2005, No. 39, pp. 212-217, Wiley-VCH , Weinheim, doi: 10.1002 / ciuz.200590038 .
- Catia Monser: Contergan, Thalidomide. Os infortúnios nunca vêm sozinhos. Eggcup, Düsseldorf 1993, ISBN 3-930004-00-3 , livro de uma pessoa afetada.
- Beate Kirk: O caso Contergan. Um desastre de drogas inevitável? Sobre a história da droga talidomida. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1999, ISBN 3-8047-1681-4 (= Greifswald escritos sobre a história da farmácia e da farmácia social , Volume 1, também dissertação na Universidade de Greifswald , 1998).
- Niklas Lenhard-Schramm: O estado da Renânia do Norte-Vestfália e o escândalo de Contergan. A Vigilância Sanitária e a Justiça Criminal nos "Longos Anos Sessenta" . Vandenhoeck & Ruprecht, Göttingen 2016, ISBN 978-3-525-30178-4 .
- Ludwig Zichner , MA Rauschmann, KD Thomann et al. (Ed.): The Contergankatastrophe . Um balanço após 40 anos. In: Anuário do Museu Alemão de História e Pesquisa Ortopédica, Frankfurt am Main. Volume 6. Steinkopff, Darmstadt 2005, ISBN 978-3-7985-1479-9 .
- Henning Sjöstrom, Robert Nilsson: A talidomida e o poder das empresas farmacêuticas . Penguin Books, 1972; Tradução alemã: Contergan ou o poder das empresas farmacêuticas. VEB Verlag Volk und Gesundheit, Berlim (Leste) 1975.
- Takumi Ito et al.: Identificação de um Alvo Primário da Teratogenicidade da Talidomida. In: Science . 327 (2010) no. 5971, pp. 1345-1350, doi: 10.1126 / science.1177319 .
- Klaus-Michael Wilsmann, Kai Zwingenberger: The contrasting history of thalidomids. Talidomida e seus campos de aplicação. In: as escalas. Revista da Grünenthal GmbH, Aachen. Volume 35, 1996, No. 2, página 66 f.
- Klaus-Dieter Thomann: A catástrofe de Contergan: a segurança enganosa de dados “sólidos” . In: Deutsches Ärzteblatt . fita 104 , não. 41 . Deutscher Ärzte-Verlag , 12 de outubro de 2007, p. A-2778 / B-2454 / C-2382 .
- A. Preuschhof, Introduction of T-Prescription - Drug Law Regulations for Dispensing Medicinal Products contendo talidomida ou lenalidomide , Pharmazeutische Zeitung 2009, 406.
Links da web
- Contergan - talidomida : extensa coleção de links anotados
- Representação na perspectiva do fabricante Contergan Grünenthal
- Inscrições no registro de estudos do NIH
- Descoberta e desenvolvimento da talidomida e seus análogos
- Peter-Philipp Schmitt: "Apenas um tablet no ônibus" . In: FAZ de 13 de maio de 2008
- Contergannetzwerk Deutschland e. V. (CND)
Evidência individual
- ↑ a b c d e Entrada sobre talidomida no banco de dados de substâncias GESTIS do IFA , acessado em 9 de janeiro de 2019. (JavaScript necessário)
- ↑ G. Mall, E. Vosseler: experiências clínicas com "Persedon". In: DMW - German Medical Weekly. 75, 1950, pág. 1084, doi: 10.1055 / s-0028-1117619 .
- ↑ a b Wolf-Dieter Müller Jahnke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte, página 146 . 2. revisado e exp. Edição. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5 .
- ^ A b c d e William Silverman: A carreira esquizofrênica de uma "droga monstro" . In: Pediatria . fita 110 , não. 2 , 22 de abril de 2002, p. 404-406 , doi : 10.1542 / peds.110.2.404 .
- ↑ a b T. Stephens e R. Brynner: remédio escuro - o impacto da talidomida e seu renascimento como um remédio vital . Cambridge, MA; Perseus Publishing; 2001, ISBN 978-0-7382-0590-8 .
- ^ Bangen, Hans: História da terapia medicamentosa da esquizofrenia. Berlin 1992, ISBN 3-927408-82-4 , página 78.
- ↑ Dietrich Böhm: A compensação das crianças Contergan. S. 159, Vorländer Verlag Siegen, 1973, apresentado em: Sociedade Alemã de Sociologia: Crianças - Corpo - Identidades: Abordagens teóricas e empíricas para a prática cultural e mudança social . Ed .: Heinz Hengst. Beltz Juventa Verlag, Weinheim 2003, ISBN 978-3-7799-0225-6 , p. 168 ( visualização limitada na Pesquisa de Livros do Google).
- ↑ a b Klaus-Dieter Thomann: A catástrofe de Contergan: a segurança enganosa dos dados "concretos" . In: Deutsches Ärzteblatt . fita 104 , não. 41 . Deutscher Ärzte-Verlag , 12 de outubro de 2007, p. A-2778 / B-2454 / C-2382 .
- ^ W. von Lenz, K. Knapp: Die Thalidomid-Embryopathie. In: German Medical Weekly . Stuttgart, 87 (24), 1962, pp. 1232-1242.
- ↑ Veja Klaus Huhn: De acordo com o relatório, supérfluo. Por que não havia talidomida na RDA.
- ↑ Veja também na RDA havia crianças com deformidades. Bundesverband: Os afetados não querem nenhum público. In: Mitteldeutsche Zeitung . 9 de novembro de 2007.
- ↑ Cf. Angelika Overath: Das Janusgesicht. Contergan. In: NZZ Folio . 01/04, tópico: comprimidos .
- ↑ Cf. Stefanie Hallberg: De horror meio a portador de esperança. Retorno do ingrediente ativo da talidomida na talidomida.
- ↑ Ver Contergan politicamente não é um problema. O prazo expirou.
- ↑ Ver Linda Bren: Frances Oldham Kelsey: O revisor médico da FDA deixa sua marca na história. In: FDA Consumer Magazine. Março / abril de 2001.
- ↑ Comunicado de imprensa da Federal Association ( Memento de 24 de fevereiro de 2016 no Internet Archive ).
- ↑ O chefe de Grünenthal encontra as vítimas da talidomida pela primeira vez , aachener-zeitung.de, 10 de dezembro de 2007.
- ↑ Campanha de assinatura .
- ↑ Catálogo de requisitos da Associação Federal ( Memento de 13 de novembro de 2010 no Arquivo da Internet ), além do qual existem outras associações.
- ↑ Comunicado de imprensa do Ministério da Família sobre a duplicação ( memento de 15 de abril de 2009 no Internet Archive ).
- ↑ Federal Association for Doubling ( Memento de 1 de janeiro de 2015 no Internet Archive )
- ↑ Comunicado de imprensa da Grünenthal: "A Grünenthal oferece aos doentes de Contergan 50 milhões de euros - a solução deve melhorar a vida das pessoas afetadas" Comunicado de imprensa da Grünenthal GmbH (PDF).
- ↑ Comunicado de imprensa RP-Online: "Grünenthal paga novamente 50 milhões de euros pelas vítimas de Contergan" ( Memento de 16 de julho de 2009 no Internet Archive ) RP Online.
- ↑ ES Fischer, K. Böhm, JR Lydeard et al. : Estrutura da ubiquitina ligase DDB1-CRBN E3 em complexo com talidomida . In: Nature . fita 512 , nº 7512 , 2014, p. 49–53 , doi : 10.1038 / nature13527 , PMID 25043012 , PMC 4423819 (texto completo gratuito).
- ↑ T. Ito, H. Ando, T. Suzuki et al.: Identificação de um alvo primário da teratogenicidade da talidomida . In: Science . fita 327 , não. 5971 , março de 2010, p. 1345-50 , doi : 10.1126 / science.1177319 , PMID 20223979 .
- ↑ a b Ito T, Ando H, Handa H: Efeitos teratogênicos da talidomida: mecanismos moleculares . In: Cell. Mol. Life Sei. fita 68 , no. 9 , 2011, p. 1569-79 , doi : 10.1007 / s00018-010-0619-9 , PMID 21207098 .
- ↑ T. Ito, H. Handa: Mecanismos moleculares da talidomida e seus derivados . In: Proc Jpn Acad Ser B Phys Biol Sei . fita 96 , no. 6 , 2020, p. 189-203 , doi : 10.2183 / pjab.96.016 , PMID 32522938 , PMC 7298168 (texto completo livre).
- ↑ Asatsuma-Okumura T, Ito T, Handa H: Mecanismos moleculares dos efeitos teratogênicos da talidomida . In: Pharmaceuticals (Basel) . fita 13 , não. 5 , 2020, doi : 10.3390 / ph13050095 , PMID 32414180 , PMC 7281272 (texto completo gratuito).
- ↑ Contergan: causa das malformações encontradas. Ärzteblatt, 3 de agosto de 2018, acessado em 1 de março de 2010 .
- ↑ Katherine A Donovan et al.: A talidomida promove a degradação de SALL4, um fator de transcrição implicado na Síndrome do Raio Radial de Duane . In: Bioquímica e Biologia Química . 1 de agosto de 2018, doi : 10.7554 / eLife.38430.001 .
- ↑ MT Miller & K. Strömland: Atualização do Teratogênio: Talidomida: Uma Revisão, Com Foco em Descobertas Oculares e Novos Usos Potenciais . In: Teratology . fita 60 , 1999, p. 306-321 , doi : 10.1002 / (SICI) 1096-9926 (199911) 60: 5 <306 :: AID-TERA11> 3.0.CO; 2-Y , PMID 10525208 .
- ^ Vaughan Monamy: Experimentação animal. Cambridge University Press, 2009, ISBN 978-0-521-87879-1 , página 84.
- ↑ Recomendações para o uso de talidomida em pacientes com mieloma múltiplo, grupo de consenso da Sociedade Alemã de Hematologia e Oncologia e da Sociedade Austríaca de Hematologia e Oncologia (PDF; 313 kB)
- ↑ Rote-Hand-Brief Talidomid ( Memento de 25 de outubro de 2013 no Internet Archive ) (PDF; 379 kB).
- ↑ A partir de 2000. Stephens TD, Bunde CJ, Fillmore BJ: Mecanismo de ação na teratogênese da talidomida . In: Biochemical Pharmacology . fita 59 , nº 12 , 2000, pp. 1489-1499 , doi : 10.1016 / s0006-2952 (99) 00388-3 , PMID 10799645 .
- ↑ T. Eriksson, S. Björkman, B. Roth, P. Höglund: Formulações intravenosas dos enantiômeros da talidomida: farmacocinética e caracterização farmacodinâmica inicial no homem . In: Journal of Pharmacy and Pharmacology . fita 52 , no. 7 , 2000, pp. 807-817 , doi : 10.1211 / 0022357001774660 , PMID 10933131 .
- ^ A b Jacques V, Czarnik AW, juiz TM, Van der Ploeg LH, DeWitt SH: Diferenciação de propriedades antiinflamatórias e antitumorigênicas de enantiômeros estabilizados de análogos da talidomida . In: Proceedings of the National Academy of Sciences USA Volume 112 , nº 12 , 2015, p. E1471-9 , doi : 10.1073 / pnas.1417832112 , PMID 25775521 , PMC 4378388 (texto completo livre).
- ↑ Teo SK, Colburn WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD, Laskin OL: Clinical Pharmacokinetics of thalidomide . In: Clinical Pharmacokinetics . fita 43 , não. 5 , 2004, p. 311-27 , doi : 10.2165 / 00003088-200443050-00004 , PMID 15080764 .
- ↑ Pischek G, Kaiser E, Koch H: A cromatografia de camada fina da talidomida e seus produtos de hidrólise . In: Microchimica Acta . Não. 3 , 1970, pág. 530-5 , doi : 10.1007 / BF01224156 , PMID 5489943 .
- ↑ Eriksson T, Björkman S, Roth B, Björk H, Höglund P: Metabólitos hidroxilados da talidomida: formação in vitro e in vivo no homem . In: Journal of Pharmacy and Pharmacology . fita 50 , não. 12 , 1998, pp. 1409-16 , PMID 10052858 .
- ↑ M. Reist, PA Carrupt, E. Francotte, B. Testa: Inversão quiral e hidrólise da talidomida: mecanismos e catálise por bases e albumina sérica e estabilidade quiral de metabólitos teratogênicos . In: Chemical Research in Toxicology . fita 11 , não. 12 , 1998, pp. 1521-8 , doi : 10.1021 / tx9801817 , PMID 9860497 .
- ↑ T. Eriksson, S. Björkman, B. Roth, A. Fyge, P. Höglund: Determinação estereoespecífica, inversão quiral in vitro e farmacocinética em humanos dos enantiômeros da talidomida . In: Quiralidade . fita 7 , não. 1 , 1995, p. 44-52 , doi : 10.1002 / chir.530070109 , PMID 7702998 .
- ^ Patente GB 768 821 (Chemie Grünenthal; 20 de fevereiro de 1957).
- ↑ W. Kunz et al .: Arzneimittel -forschung 6 (1956) 426-430.
- ^ A b W. A. Silverman: A carreira esquizofrênica de uma "droga monstro" . Em pediatria . 110 (2 Pt 1), agosto de 2002, páginas 404-406. PMID 12165600 .
- ↑ L. Calabrese, AB Fleischer: Talidomida: aplicações clínicas atuais e potenciais. In: The American Journal of Medicine. Volume 108, Número 6, abril de 2000, pp. 487-495. PMID 10781782 , (revisão).
- ↑ Jeffrey M. Jacobson et al .: Talidomida para o tratamento de úlceras aftosas orais em pacientes com infecção pelo vírus da imunodeficiência humana. Em: New England Journal of Medicine , Volume 336, No. 21, 1997, pp. 1487-1493, doi: 10.1056 / NEJM199705223362103 .
- ↑ WD Figg, MH Hussain et al: Um estudo duplo-cego randomizado cruzado de talidomida oral versus placebo para câncer de próstata dependente de androgênio tratado com ablação androgênica intermitente. In: The Journal of Urology . 181, 2009, pp. 1104-1113. doi: 10.1016 / j.juro.2008.11.026 . PMID 19167733 . PMC 2838198 (texto completo gratuito).
- ↑ Cf. S. Hallberg: De droga de horror a esperançoso: retorno do ingrediente ativo da talidomida.
- ^ S. Singhal, J. Mehta e outros: atividade antitumoral da talidomida em mieloma múltiplo refratário. In: The New England Journal of Medicine. Volume 341, Número 21, novembro de 1999, pp. 1565-1571, doi: 10.1056 / NEJM199911183412102 . PMID 10564685 .
- ↑ T. Hideshima, D. Chauhan et al: A talidomida e seus análogos superam a resistência às drogas de células de mieloma múltiplo humano à terapia convencional. In: Blood . Volume 96, Número 9, novembro de 2000, pp. 2943-2950. PMID 11049970 .
- ↑ Apêndice: cápsulas de 50 mg de Thalidomide Celgene , 6 de maio de 2008 (PDF, inglês; 516 kB).
- ↑ Vanessa Piechotta, Tina Jakob, Peter Langer, Ina Monsef, Christof Scheid: Combinações múltiplas de bortezomibe, lenalidomida e talidomida para tratamento de primeira linha em adultos com mieloma múltiplo inelegível para transplante: uma meta-análise de rede . In: Cochrane Database of Systematic Reviews . 25 de novembro de 2019, doi : 10.1002 / 14651858.CD013487 .
- ↑ Marzia Lazzerini, Stefano Martelossi et al.: Efeito da talidomida na remissão clínica em crianças e adolescentes com doença de Crohn refratária. In: Journal of the American Medical Association . 310, 2013, p. 2164, doi: 10.1001 / jama.2013.280777 .
- ↑ Comunicado de imprensa da Celgene Inc. ( Memento de 11 de julho de 2012 no arquivo do arquivo da web . Hoje ).
- ↑ Instituto Federal de Medicamentos e Dispositivos Médicos: Anúncio sobre a Portaria de Prescrição de Medicamentos de 17 de junho de 2011 , BAnz, p. 99, de 6 de julho de 2011, p. 2.415.
- ↑ Portaria de Prescrição de Medicamentos (AMVV) § 3a .
- ↑ Hubert Giess: MEDICAMENTOS: Comeback for Contergan. In: Focus Online . 2 de maio de 1994, acessado em 10 de outubro de 2015 .