Hemostasia
A hemostasia (composto de grego antigo αἷμα Haima , Alemão , sangue 'e estase de στάσις estase , Alemão , estiva' , hemostasia 'estagnação', 'stop') é um processo vital das lesões da vasos sanguíneos resultando sangramento traz a uma paralisação. Isso evita o vazamento excessivo de sangue da corrente sanguínea e cria as condições para a cicatrização de feridas . Em caso de lesão, a hemostasia deve ser iniciada com rapidez suficiente para evitar grande perda de sangue. Deve ser confinado à área da lesão e não deve ser erroneamente desencadeado por outros eventos, como inflamação ou infecção .
A hemostasia pode ser dividida em dois subprocessos, que, entretanto, interagem entre si. Na hemostasia primária (também: celular), a hemostasia (fisiológica ), as plaquetas sanguíneas ( trombócitos ), as células da parede do vaso sanguíneo afetado ( endotélio e células musculares lisas ), bem como o tecido externo ao vaso, estão envolvidos. Para simplificar, o vaso primeiro se estreita e, em seguida, as plaquetas sanguíneas aderem ao vazamento, grudam-se umas nas outras e, assim, criam o primeiro fechamento da ferida. Na hemostasia secundária (também: plasmática), a coagulação do sangue , esse fechamento ainda solto é reforçado pela formação de fios de fibrina . A ativação de cerca de uma dúzia de fatores de coagulação contidos no plasma sanguíneo desempenha um papel importante aqui. Um defeito genético nos fatores de coagulação pode levar a doenças como a hemofilia (doença do sangue ). O início da cicatrização de feridas é iniciado por fatores de crescimento que são liberados pelas plaquetas e células endoteliais. No final do processo de cicatrização da ferida, a fibrina é dissolvida pelo sistema fibrinolítico do plasma sanguíneo.
A hemostasia, com seus dois componentes, hemostasia primária e secundária, é freqüentemente chamada de hemostasia.
Sob hipercoagulável significa o aumento da atividade de coagulação. A hemostasia é o estudo da hemostasia. Uma coagulopatia ou distúrbio da coagulação do sangue é entendido como uma hemostasia patologicamente alterada.
Este artigo descreve a hemostasia em humanos. A maioria das afirmações também se aplica a outros mamíferos , mas apenas até certo ponto, a outras classes de animais .
Processos fisiológicos após uma lesão vascular
Após a lesão de vasos menores, o sangramento geralmente para rapidamente. A hemostasia responsável por isso pode ser vista como uma sequência dos seguintes processos. Essa subdivisão serve principalmente para torná-lo mais fácil de entender. Existem relações funcionais e temporais estreitas entre os processos, uma demarcação clara não é possível.
- Hemostasia arterial espontânea
- Artérias ( artérias ) do tipo muscular têm a propriedade de "einzukrempeln" após um corte transversal por si só. Esta propriedade é devida à construção da parede das artérias: a pele interna elástica da artéria (membrana elástica interna) se contrai mais do que as outras camadas da parede depois de ter sido cortada. Como resultado, a borda livre da artéria cortada é puxada para o interior do vaso e, assim, garante um fechamento provisório muito rápido.
- Hemostasia celular
- Consiste na fixação (adesão) e colagem (agregação) de plaquetas, a ativação de outras plaquetas e a formação de um trombo plaquetário branco oclusivo. Além disso, a liberação de substâncias desencadeia vasoconstrição, ou seja, estreitamento dos vasos sanguíneos. Isso diminuirá o fluxo sanguíneo e, assim, minimizará a perda de sangue.
- Hemostasia plasmática
- Os componentes do plasma sanguíneo criam uma rede de fios de fibrina mecanicamente estáveis, na qual os glóbulos vermelhos circulantes (eritrócitos) são capturados e, finalmente, se forma um trombo vermelho, que finalmente se solidifica e se contrai.
Hemostasia celular
O sangue de uma pessoa normalmente contém entre 150.000 e 400.000 plaquetas por microlitro . A membrana celular das plaquetas contém numerosas glicoproteínas e receptores que desempenham um papel importante na hemostasia celular.
A camada celular interna dos vasos sanguíneos é chamada de endotélio . É coberto internamente por um glicocálice , uma espécie de camada de muco para a qual as plaquetas não têm receptores. Por esta razão, entre outras coisas, as plaquetas permanecem inativas nos vasos não lesados e não podem se prender à parede do vaso. Vários fatores também neutralizam a ativação, por exemplo, prostaciclina e óxido nítrico , bem como heparina , que é formada, entre outras coisas, por mastócitos e cujo efeito inibitório na hemostasia pode ser usado terapeuticamente .
Adesão e ativação plaquetária
Quando um vaso é lesado, o sangue entra em contato com o tecido conjuntivo circundante, incluindo as fibras de colágeno. O colágeno é uma proteína estrutural que está presente em quase todo o espaço extracelular . As plaquetas aderem primeiro a essas fibras ( adesão plaquetária ), o que leva à formação de uma fina cobertura da ferida. A adesão (adesividade) é preparada pelo Fator de Von Willebrand mediado (vWF), uma proteína do sangue solúvel de células endoteliais e megacariócitos é formada. Junto com a fibronectina e a laminina, ele cria uma conexão entre as fibras de colágeno e um receptor nas plaquetas (GP Ib / V / IX). Um defeito no fator de Von Willebrand leva à síndrome de Willebrand-Jürgens .
A adesão desencadeia a ativação plaquetária: eles liberam íons de cálcio , ADP , serotonina , tromboxano A 2 e outras substâncias dos chamados "grânulos densos de elétrons" . Isso atrai mais plaquetas ( quimiotaxia ). O tromboxano A 2 também contribui significativamente para o estreitamento dos vasos sanguíneos, o que neutraliza um alto fluxo sanguíneo. Também é liberado o conteúdo dos chamados “grânulos α” das plaquetas: fatores de coagulação (fator V, fator VIII), adesivos (FvW, fibronectina, trombospondina) e fatores de crescimento . Ao ativar várias vias metabólicas , substâncias como o tromboxano A 2 e o PAF (Fator de Ativação de Plaquetas) são cada vez mais formadas. Algumas dessas substâncias induzem a coagulação plasmática.
Agregação de plaquetas

A agregação das plaquetas ativadas é promovida por uma reorganização do citoesqueleto , que faz com que a superfície celular aumente várias vezes. Enquanto as plaquetas estão inativas, em forma de lente , quando estão ativas assumem uma forma esférica e carregam longos pseudópodes ( pseudópodes ) com a ajuda dos quais podem se enganchar - as plaquetas tornam-se "espinhosas" e "pegajosas". As plaquetas agregadas eventualmente formam um tampão plaquetário conhecido como trombo branco. Isso termina a hemostasia celular. Normalmente, o processo leva de um a quatro minutos, essa duração é chamada de tempo de sangramento .
O trombo branco não é muito estável e pode ser removido pela lavagem. A hemostasia plasmática forma uma vedação mais firme .
Hemostasia plasmática
A hemostasia plasmática cria uma rede de fibrina mecanicamente estável, na qual não apenas os trombócitos, mas também os glóbulos vermelhos ( eritrócitos ) são capturados, o que é, portanto, referido como “trombo vermelho”.
As plaquetas ativadas possuem um complexo receptor (glicoproteína IIb / IIIa) na membrana celular, ao qual se ligam o fibrinogênio do plasma e os adesivos liberados das plaquetas ativadas (fibronectina, trombospondina). Os mecanismos de feedback das substâncias liberadas levam, em última instância, à agregação irreversível, na qual as membranas celulares das plaquetas se fundem umas com as outras.
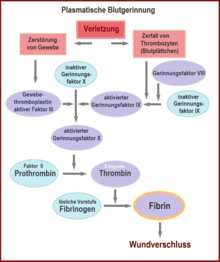
Essa hemostasia secundária, a coagulação do sangue, também é conhecida como cascata de coagulação. É dividido em três fases: fase de ativação, coagulação e retração.
Fase de ativação
Quando as plaquetas entram em contato com superfícies carregadas negativamente, como o vidro, os fatores XII e XI são ativados, o que coloca em movimento uma cascata de coagulação ( sistema intrínseco , ver figura). Se o fator XII não é produzido em um indivíduo, isso não resulta em um distúrbio significativo da coagulação, ao contrário da deficiência dos fatores VIII, IX e XI, que leva à hemofilia A, B e C.
O processo fisiológico normal ( sistema extrínseco ou mecanismo exógeno) é iniciado pelo contato do sangue com a tromboplastina do tecido do tecido subendotelial lesado. O fator tecidual (também Fator Tecidual (FT), tromboplastina tecidual ou fator III) é uma proteína de membrana que, por exemplo, na adventícia ocorre os vasos sanguíneos - pelas células endoteliais é liberado somente após a ativação. Ele forma um complexo com o fator VII, que é convertido em sua forma ativa. Como resultado, alguma trombina é formada, mas o processo é inibido de forma relativamente rápida pelo TFPI (Tissue Factor Pathway Inhibitor). Quando uma quantidade suficiente de trombina foi formada, um denominado complexo ativador de fatores IX e VIII é ativado (ver IXa e VIIIa na Figura). Este complexo, por sua vez, ativa o fator X.
A ausência dos fatores VIII ou IX leva à hemofilia, a hemofilia: a cascata é interrompida e a coagulação não é intensificada. Os pacientes podem sangrar até a morte devido aos menores ferimentos internos.
Com ambos os mecanismos - via intrínseca e extrínseca - o fator X é finalmente ativado em fator Xa. Este, por sua vez, divide a protrombina (fator II), resultando em trombina (fator IIa). Essa reação na membrana plaquetária ocorre apenas na presença de cálcio e é bastante acelerada pelo feedback positivo com o complexo de fatores VIII e IX. A fase de ativação termina com a formação de trombina enzimaticamente ativa.
Fases de coagulação e retração
A trombina enzimaticamente ativa é responsável pela polimerização da fibrina e, portanto, pela formação do trombo vermelho: na fase de coagulação, ela se separa das unidades de baixo peso molecular ( monômeros ) do precursor fibrinogênio inativo (fator I) , que são não covalentemente combinado para formar fibrina polimérica. Finalmente, por meio da ação do fator XIII, ligações covalentes são feitas entre os monômeros e o trombo é estabilizado. A fibrina liga os trombócitos que já estão ligados uns aos outros e, assim, fortalece o fechamento da ferida. Os glóbulos vermelhos ficam presos na rede, formando-se um chamado trombo vermelho. A trombina também causa uma contração do esqueleto de actina-miosina dentro das plaquetas: as plaquetas em contração se juntam na rede de fibrina e, portanto, nas bordas da ferida e fecham a ferida mecanicamente. A contração - suportada pelo PDGF ( fator de crescimento derivado das plaquetas ) - também promove a penetração das células do tecido conjuntivo: inicia-se a cicatrização.
Novo modelo de coagulação baseado em células
O modelo clássico de coagulação diferencia a ativação intrínseca da extrínseca e, portanto, descreve uma sequência de vários estágios de ativação de proteínas no plasma livre de células. Os testes clássicos de coagulação aPTT e PT correspondem a esta ideia. Este modelo não é adequado para descrever a coagulação do sangue em vasos sanguíneos danificados no corpo, de modo que em 2001 foi estabelecido um modelo de coagulação baseado em células, que descreve três fases sobrepostas:
iniciação
Como resultado de uma lesão no tecido, as células localizadas fora do vaso sanguíneo entram em contato com a corrente sanguínea abaixo do endotélio vascular. As células agora abertas na corrente sanguínea carregam o fator de tecido (III) em sua superfície (célula portadora do fator de tecido (III)). O complexo de fator tecidual (III) e proconvertina (VII) agora catalisa a ativação da trombocinase (X), que pode inicialmente ativar apenas pequenas quantidades de trombina (II). Porém, essa pequena quantidade de trombina (II) é suficiente para ativar as plaquetas e os fatores de coagulação proaccelerina (V) e proconvertina (VII) e, assim, desencadear a amplificação da formação de trombina. Essa primeira fase ocorre em um pequeno espaço na lesão subendotelial.
Amplificação
A proaccelerina (V) ativada na fase de iniciação forma o complexo protrombinase (X, V) com a trombocinase (X), que pode ativar mais a trombina (II). A fase de amplificação, durante a qual as plaquetas aderem às estruturas subendoteliais (adesão), se sobrepõe com o tempo. Isso acontece por meio dos receptores GPVI, que se ligam ao colágeno, e por meio do receptor GPIb / IX, que se liga ao fator de Von Willebrand. O complexo de Von Willebrand libera o fator VIII ligado, que se liga de forma ativa à superfície das plaquetas. Além disso, as plaquetas liberam seus estoques internos, que, entre outras coisas, também contêm Proaccelerin (V). O fator tecidual (III) e a proconvertina (VII) não ativam apenas a trombocinase (X), mas também a serina protease (IX). As primeiras pequenas quantidades de trombina (II) ativam não apenas a fibrina (I), mas também o fator (VIII). O complexo tenase formado a partir de VIII e IX, por sua vez, ativa a trombocinase (X), de modo que uma alça de auto-reforço é formada. Essa etapa importante também é conhecida como loop de Josso. Agora, existem numerosos fatores de coagulação em alta concentração na superfície da lesão subendotelial e na superfície do trombócito aderente a ela e que estão protegidos das proteínas anticoagulantes do sangue livre.

Propagação
Os fatores acumulados na superfície das plaquetas formam complexos tenase (VIII, IX), que suportam a formação do complexo protrombinase (X, V). A trombocinase (X) agora ativa grandes quantidades de trombina (II) (explosão de trombina). A trombina (II) finalmente forma as redes de fibrina nas quais as plaquetas se ligam aos seus receptores GPIIb / IIIa. O fator XIII estabiliza essas redes por meio de conexões cruzadas de fibrina adicionais.
Controle de propagação indesejada do coágulo
Para evitar a formação de um coágulo fora da lesão endotelial (trombose), o endotélio e o sangue que flui livremente têm mecanismos diferentes: A trombina em dissolução (II) é rapidamente desativada na corrente sanguínea pela proteína anticoagulante antitrombina. A trombocinase em dissolução (X) e a proconvertina (VII) são ligadas por TFPI. Na superfície do endotélio existe a trombomodulina (TM), que se liga à trombina (II) de forma que ela não pode mais formar fibrina (I). Ao mesmo tempo, a formação da proteína C (APC) pela trombina ligada (II) é mil vezes maior, de modo que a trombina agora tem efeito anticoagulante. A proteína C (APC) forma então um complexo com a proteína S, que desativa os fatores de coagulação V e VIII. O endotélio também possui ADPases ligadas à membrana que quebram o ADP e, portanto, regulam negativamente a função plaquetária.
Transição para a cicatrização de feridas
Após a hemostasia plasmática, a ferida cicatriza quando as células que formam o tecido conjuntivo ( fibroblastos ) crescem no trombo e o transformam em tecido conjuntivo. As células danificadas morrem e são decompostas. Uma proteína chamada plasmina é a principal responsável por quebrar o trombo , que também é formado a partir de um precursor inativo (plasminogênio) por mecanismos regulados de forma complexa. A plasmina dissolve as ligações covalentes entre os filamentos de fibrina e, portanto, a rede que mantém o trombo no lugar.
Existem equilíbrios equilibrados entre os sistemas de coagulação do sangue e o sistema de fibrinólise , que dissolve o trombo vermelho no sistema vascular. Pequenos distúrbios deste equilíbrio podem levar a hemorragias graves ou à formação de trombos em locais onde não há lesões (ver também Trombose ).
Visão geral dos fatores de coagulação e inibidores
Exceto para íons de cálcio (fator IV), os fatores de coagulação são proteínas. Um número romano é atribuído a cada fator. Um minúsculas um após os meios Número que é na forma activa. Por razões históricas (consulte o histórico de pesquisa ), o número VI não é atribuído (mais), o fator correspondente é idêntico ao Va.
| número | Nome (s) | Funções | Síndromes de Deficiência |
|---|---|---|---|
| EU. | Fibrinogênio | Molécula precursora para a formação da rede de fibrina. | Afibrinogenemia ( coagulopatia congênita ou de consumo ) |
| II | Protrombina | A forma ativa trombina (IIa) ativa os fatores I, V, VIII, XI e XIII. | Hipoprotrombinemia (congênita, deficiência de vitamina K ou coagulopatia de consumo ) |
| III | Fator tecidual , tromboplastina tecidual, fator tecidual (TF) | O único não no sangue, mas no tecido subendotelial.
TF e VIIa formam a tenase extrínseca com Ca 2+ , que ativa X. |
|
| 4 | Cálcio | Muitos fatores requerem o cátion cálcio Ca 2+ para se ligar aos fosfolipídios carregados negativamente das membranas plasmáticas. | Deficiência de cálcio |
| V | Proaccelerin | Va e Xa formam o complexo de protrombinase com Ca 2+ e fosfolipídios , que ativa II. | Para-hemofilia (congênita) |
| VI | corresponde ao fator Va | ||
| VII | Proconvertin | VIIa e TF formam a tenase extrínseca com Ca 2+ , que ativa X. | Hipoproconvertinemia (congênita, deficiência de vitamina K) |
| VIII | Globulina A anti-hemofílica. | VIIIa e IXa formam a tenase intrínseca com Ca 2+ e fosfolipídios , que ativa X. | Hemofilia A (herança congênita, recessiva ligada ao X) |
| IX | Fator de natal , globulina B anti-hemofílica | VIIIa e IXa formam a tenase intrínseca com Ca 2+ e fosfolipídios , que ativa X. | Hemofilia B (herança congênita, recessiva ligada ao X) |
| X | Fator Stuart Prower | Va e Xa formam o complexo de protrombinase com Ca 2+ e fosfolipídios , que ativa II. | Deficiência de fator X (congênita) |
| XI | Fator de Rosenthal , Antecedente de Tromboplasmina de Plasma (PTA) | XIa ativado IX. | Hemofilia C (congênita) ou deficiência de PTA na coagulopatia de consumo |
| XII | Fator de Hageman | XIIa ativou XI. | A síndrome de Hageman tem maior probabilidade de causar distúrbios de fibrinólise ( coagulopatia congênita ou de consumo ) |
| XIII | Fator de estabilização de fibrina | XIIIa converte monômeros de fibrina em fibrina reticulada. | Deficiência de Fator XIII |
Para evitar a coagulação na ausência de lesão, o plasma sanguíneo contém várias substâncias inibidoras ( inibidores ). Os inibidores de protease inibem a formação de fibrina. A antitrombina inibe várias proteases de coagulação na fase de ativação e na fase de coagulação. O efeito inibitório é significativamente aumentado por seu cofator, a heparina . A heparina é produzida por células endoteliais e mastócitos . A trombomodulina , que também vem do endotélio, liga-se à trombina e ativa a proteína C , que após se ligar à proteína S inativa os cofatores Va e VIIIa.
História da pesquisa
Até 1772, sustentava-se a ideia de Aristóteles de que a coagulação do sangue devia ser comparada ao congelamento de líquidos.
As primeiras teorias de hemostasia interpretavam o sangue coagulado no contexto da patologia humoral como " bile negra ". O estudo dos mecanismos fisiológicos começou no século XVII. Em 1772, William Hewson mostrou que existe uma linfa no sangue responsável pela coagulação. No século 18, prevaleceu novamente a opinião de que quando o sangue coagula, o movimento do sangue para e que quando as partículas suspensas se instalam, ocorre a impressão de coagulação do sangue. Em 1821, Jean Louis Prévost e Jean Baptiste André Dumas fizeram um grande avanço na pesquisa: Coagulação é a união de células sanguíneas e fibrina. Johannes Müller determinou que a fibrina deve ser dissolvida no sangue; Rudolf Virchow foi capaz de fornecer maiores explicações em 1856, quando encontrou o precursor da fibrina, que ele chamou de fibrinogênio. 1830 a 1859 Próspero Sylvain Denis de Commercy (1799-1863) realizou vários estudos nos quais constatou, entre outras coisas, a instabilidade do coágulo. Ele também conseguiu precipitar a serofibrina do plasma, que chamou de plasmina.
Alexander Schmidt (1831-1894) propôs uma teoria da coagulação em 1876, que se baseava na interação de proteínas. Ele também descreveu o papel do cálcio. Por muito tempo se discutiu quais substâncias são realmente necessárias para a coagulação e se a fase celular ou plasmática é a mais importante.
Olof Hammarsten (1841-1932) e Léon Fredericq (1851-1939) mostraram em 1875 que o fermento de fibrina e o fibrinogênio são as únicas substâncias que param o sangramento e que não é uma substância fibrinoplástica. Schmidt continuou pesquisando esse fermento e o chamou de trombina. Ele também fez a tese de que deve haver protrombina no plasma.
Em 1904, Paul Morawitz descreveu o sistema quase como é conhecido hoje. Ele cunhou o termo coagulação plasmática e descreveu as duas fases seguintes
Os mecanismos moleculares da coagulação do sangue foram amplamente descobertos durante o século XX. Uma primeira indicação da complexidade dos mecanismos de coagulação do sangue foi a descoberta da proaccelerina por Paul Owren (1905–1990) em 1947, que foi referido como fator V. A sequência de aminoácidos completa foi publicada em 1987 por Jenny et al. liberado. Owren já suspeitava que esse fator produzisse a acelerina, que ele chamou de fator VI. Mais tarde, descobriu-se que o fator V é o precursor inativo do fator VI. Portanto, o fator VI agora é conhecido como fator Va.
O fator IX foi descoberto em 1952 como resultado da doença de um jovem paciente com hemofilia B chamado Stephen Christmas, em quem a ausência desse fator causou a doença. É por isso que é chamado de fator de Natal. Muitos dos outros fatores também foram descobertos na década de 1950 e costumam receber o nome dos pacientes nos quais foram encontrados. Os detalhes dessas descobertas são descritos nos artigos para os respectivos fatores.
Só recentemente foi descoberto que a via intrínseca não desempenha um papel fisiológico, ou seja, pode ser observada in vitro, mas não in vivo .
Significado clínico
Anticoagulante Medicinal
Antes, durante e após as operações, bem como quando acamado por outros motivos, medicamentos anticoagulantes temporários (muitas vezes chamados incorretamente como anticoagulantes) são freqüentemente usados para prevenir trombose e embolia pulmonar . Essa abordagem é chamada de profilaxia da trombose .
A razão mais comum para a anticoagulação terapêutica de longo prazo hoje em dia é a fibrilação ou flutter atrial. Com essa arritmia cardíaca, há um risco aumentado de embolia, que em muitos pacientes deve ser reduzido com o uso de anticoagulantes. O segundo motivo mais comum é a trombose, principalmente das veias das pernas. Aqui, a anticoagulação na fase aguda tem como objetivo prevenir a expansão da trombose e posterior recorrência (recidiva).
Heparina
Para a inibição de drogas de coagulação in vivo pode heparina e heparinóides, pode ser utilizado. É uma cadeia de açúcares extremamente fortemente carregada negativamente que se liga à proteína antitrombina mencionada acima . Este complexo agora liga de forma mais eficaz os fatores trombina e Xa, que são assim anulados: a cascata de coagulação pára. O efeito começa imediatamente após a administração intravenosa. A heparina para uso medicinal é geralmente obtida de tecidos animais.
Cumarinas
Outra possibilidade são os chamados antagonistas da vitamina K , como os derivados cumarínicos fenprocumon e varfarina . A vitamina K é necessária como coenzima para a síntese da maioria dos fatores de coagulação . A cumarina atua no fígado e previne a redução da vitamina K ( filoquinona ). Este participa da γ- carboxilação dos fatores de coagulação (II, VII, IX, X) e é ele próprio oxidado (liberação de elétrons ). Sem uma redução subsequente (captação de elétrons), a vitamina K permanece sem função. O efeito só se instala após um certo tempo, mas pode ser administrado por via oral.
Drogas antiplaquetárias
O ácido acetilsalicílico pode intervir na agregação plaquetária, ou seja, na hemostasia celular. A ciclo-oxigenase (COX), que é necessária para a síntese do factor de plaquetas tromboxano A 2 , é irreversivelmente inibida pela ligação de um ácido acético resíduo. O clopidogrel também atua na agregação das plaquetas sanguíneas , inibindo a ativação plaquetária dependente de ADP por meio do bloqueio irreversível do receptor. O abciximab é um anticorpo monoclonal recombinante que bloqueia a glicoproteína IIb / IIIa das plaquetas e, portanto, também evita a agregação plaquetária. O mesmo local de ataque é Tirofiban .
Fibrinolíticos
Os fibrinolíticos ativam o plasminogênio e, assim, promovem a dissolução de trombos ( trombólise ). É utilizado no tratamento de ataques cardíacos , embolias pulmonares , tromboses das veias das pernas , doenças oclusivas periféricas e, numa janela de tempo de quatro horas, também para enfartes cerebrais agudos . Embora as substâncias ativas, como a estreptoquinase e a uroquinase, tenham um efeito não específico no fibrinogênio e na fibrina, as substâncias mais recentes, como a alteplase ( ativador do plasminogênio do tipo de tecido recombinante , rt-PA), têm seletividade para a fibrina reticulada em trombos, que se destina para reduzir os efeitos colaterais sistêmicos, especialmente sangramento. O uso de fibrinolíticos está sujeito a indicações estritas.
Inibição in vitro
In vitro , por ex. B. em tubos de sangue, EDTA e citrato são freqüentemente usados, quelantes que formam um complexo com os cátions de cálcio necessários para a coagulação. A anticoagulação com heparina também é possível in vitro. A seleção do anticoagulante é baseada em qual exame é planejado posteriormente com o sangue que foi tornado não coagulável. Para investigações da própria coagulação, o citrato é usado quase exclusivamente como anticoagulante, diluindo a amostra de sangue em uma proporção de 9 + 1 com uma solução de citrato de sódio 3,8% . Via de regra, utilizam-se para isso tubos pré-fabricados industrialmente, que já contêm 0,3 ml de solução de citrato de sódio e são preenchidos com 2,7 ml de sangue. Para a confiabilidade das análises resultantes, é importante que essa proporção de mistura seja observada com precisão e que a amostra de sangue seja cuidadosamente misturada com a solução de citrato de sódio imediatamente após a coleta.
Aumento da hemostasia por drogas
Faz sentido querer influenciar a hemostasia na direção oposta e, no caso de sangramento com risco de vida, administrar medicamentos que levem ao aumento da hemostasia. No passado, o desenvolvimento de tais medicamentos, chamados de hemostípticos em termos técnicos , teve menos sucesso do que com medicamentos que inibem a hemostasia.
As preparações que curam uma deficiência herdada ou adquirida de fatores de coagulação, por exemplo, concentrado de fator VIII para hemofilia A, vitamina K e PPSB para sangramento sob terapia cumarínica ou plasma fresco congelado para coagulação intravascular disseminada tornaram-se importantes para o tratamento médico . Se houver uma escassez pronunciada de plaquetas sanguíneas, elas podem ser substituídas na forma de concentrados de plaquetas . O efeito da heparina pode ser cancelado pela protamina .
Além disso, a hemostasia pode ser aumentada pela inibição do antagonista natural da coagulação, a fibrinólise. Os medicamentos com esse mecanismo de ação são chamados de antifibrinolíticos . Os ingredientes activos utilizados são o ácido tranexâmico , para- ácido aminometilbenzóico e ácido ε-aminocapróico , o previamente utilizado frequentemente aprotinina foi retirado do mercado, em Novembro de 2007, devido a um aumento da mortalidade durante o tratamento.
O álcool butílico na preparação hemostíptica Revici revelou-se inadequado porque seu modo de ação estava dentro da faixa de especulação .
Testes de coagulação
A medição da coagulação do sangue (coagulabilidade, coagulação, coagulabilidade) é chamada de coagulometria , os dispositivos correspondentes são chamados de coagulômetros. O resultado da medição da coagulação do sangue é o estado da coagulação ( coagulograma ).
| Abr. | Descrição | unidade | Valor padrão | material | Ativador | Monitoramento de |
|---|---|---|---|---|---|---|
| TPZ, PT | Tempo de tromboplastina, tempo de protrombina | Segundos | 11-16 | Plasma citratado após centrifugação | Trombocinase tecidual = fator tecidual = tromboplastina = fator III | Início do sistema de coagulação extrínseca, terapia com antagonistas da vitamina K |
| Rápido | corresponde a TPZ, PT em comparação com plasma padrão | por cento | 70-125% | Plasma citratado após centrifugação | Veja acima | Veja acima |
| EM R | corresponde a TPZ padronizado, PT em comparação com plasma padrão | 0,8 - 1,2 | Plasma citratado após centrifugação | Veja acima | Veja acima | |
| aPTT | (ativado) Tempo de tromboplastina parcial | Segundos | 20-38 | Plasma citratado após centrifugação | Fosfolipídios (também desatualizados: tromboplastina parcial ou fator de plaquetas 3, um extrato de fosfolipídio livre de proteína) e uma substância de superfície ativa (por exemplo, caulim) | Tempo de início do sistema de coagulação intrínseca, terapia com heparina |
| AGIR | Tempo de coagulação ativado, tempo de coagulação do caulim | Segundos | 100-130 | Cheio de sangue | substância de superfície ativa (por exemplo, caulim) | Tempo de início do sistema de coagulação intrínseca, terapia com heparina, medição próxima ao paciente de sangue total possível z. B. com HLM ou ECMO |
| PTZ, TZ | Tempo de trombina plasmática, tempo de trombina | Segundos | 20-38 | Plasma citratado após centrifugação | Trombina | Início da seção final comum do sistema de coagulação, terapia com heparina |
| Multiplate® ASPI | agregometria de impedância plaquetária comercial | Área sob a curva | > 40 | Hirudina sangue total | Ácido araquidônico (como substrato para a COX para a produção de tromboxano A2) | Função plaquetária, inibidores COX: ASA (por exemplo, aspirina), NSAIDs |
| Multiplate® ADP | agregometria de impedância plaquetária comercial | Área sob a curva | > 40 | Hirudina sangue total | ADP | Função plaquetária, antagonistas do receptor ADP: clopidogrel, prasugrel |
| Multiplate® TRAP | agregometria de impedância plaquetária comercial | Área sob a curva | > 40 | Hirudina sangue total | Peptídeo de ativação do receptor de trombina (TRAP-6) | Função plaquetária, antagonistas da glicoproteína IIb / IIIa, defeito mecânico das plaquetas |
| ROTEM® EXTEM | trombelastometria comercial
CT = Tempo de coagulação CFT = Tempo de formação do coágulo MCF = Firmeza máxima do coágulo ML = Lise máxima |
Sangue total com citrato | Trombocinase tecidual = fator tecidual = tromboplastina = fator III | Tempo de início do sistema extrínseco de coagulação, força do coágulo, duração da persistência do coágulo, terapia com antagonistas da vitamina K | ||
| ROTEM®
INTEM |
Veja acima | Sangue total com citrato | Fosfolipídeo de tromboplastina parcial de cérebro de coelho | Tempo de início do sistema de coagulação intrínseco, força do coágulo, tempo de persistência do coágulo, terapia com heparina | ||
| ROTEM® HEPTEM | Veja acima | Sangue total com citrato | Fosfolipídeo de tromboplastina parcial de cérebro de coelho
+ Heparinase para acabar com o efeito da heparina |
Tempo de início do sistema de coagulação intrínseca, força do coágulo, tempo de persistência do coágulo,
após a remoção do efeito da heparina |
||
| ROTEM® FIBTEM | Veja acima | Sangue total com citrato | Trombocinase tecidual = fator tecidual = tromboplastina = fator III
+ Citocalasina D para inibir as plaquetas |
Tempo de início do sistema extrínseco de coagulação, força do coágulo, tempo de persistência do coágulo SEM efeito plaquetário d. H. o efeito do fibrinogênio isolado é evidente | ||
| ROTEM®
APTEM |
Veja acima | Sangue total com citrato | Trombocinase tecidual = fator tecidual = tromboplastina = fator III
+ Aprotinina para inibir a hiperfibrinólise |
especialmente a persistência do coágulo, que é encurtada pela hiperfibrinólise |
Os diagnósticos de laboratório médico são usados para medir a coagulabilidade do sangue
- o valor rápido para a determinação seletiva da função do sistema exógeno pela adição de fator tecidual e Ca 2+ à amostra de sangue e, em seguida, determinação do tempo de coagulação em relação ao sangue normal, por exemplo na terapia cumarínica, bem como o INR (Internacional Razão normalizada) derivada dele, o que corresponde ao teste rápido está cada vez mais sendo substituído. O INR oferece melhor comparabilidade entre laboratórios diferentes do que o valor Quick. No entanto, ambos os valores são normais na hemofilia.
- o PTT (Tempo parcial de tromboplastina) para a determinação seletiva da função do sistema endógeno e da via comum de coagulação do sangue. No caso da hemofilia, esse valor está acima do valor padrão de aproximadamente 30 segundos.
Esses testes são conhecidos como testes de coagulação global. Eles podem apenas detectar redução da coagulação (risco de sangramento) e monitorar o tratamento com medicamentos anticoagulantes como Marcumar, mas não muito ( trombofilia ). Além disso, os testes usados com menos frequência para medir a coagulabilidade do sangue são o tempo de trombina e a determinação de fibrinogênio funcional de acordo com Clauss.
O estado de ativação do sistema de coagulação em todo o corpo pode ser determinado medindo os dímeros D (produtos de degradação da fibrina). Desta forma, certos estados de doença que estão presentes no momento da coleta de sangue e estão associados à ativação da coagulação plasmática podem ser reconhecidos ( trombose , embolia pulmonar , coagulação intravascular disseminada e trombocitopenia induzida por heparina tipo II). A diferenciação entre as diferentes causas possíveis de ativação da coagulação e uma avaliação confiável de um risco futuro (trombofilia) não é possível pela determinação dos dímeros-D. Atualmente, não existe um exame de busca adequado para trombofilia, mas, se houver suspeita correspondente, todas as possíveis causas devem ser excluídas individualmente.
Uma avaliação do valor Quick e do PTT em relação a uma tendência ao sangramento deve sempre incluir um histórico de sangramento detalhado, o número e, se necessário, a função das plaquetas sanguíneas ( trombócitos ). A hemostasia celular é muito mais difícil de avaliar do que a plasmática. Apenas o número de plaquetas sanguíneas pode ser determinado de forma fácil e confiável, mas não sua função. Os testes fornecidos para esse fim não são confiáveis (tempo de sangramento) ou complexos e, portanto, não estão disponíveis em todos os lugares ( trombelastograma , analisador da função plaquetária).
Antes das operações, mesmo em pacientes que não estão tomando qualquer medicação anticoagulante, uma avaliação aproximada da situação de coagulação com base nesses três parâmetros (Quick, PTT e contagem de plaquetas) é frequentemente realizada para identificar distúrbios de hemostasia não relacionados ao medicamento. Essa prática agora é controversa no meio de especialistas, pois apenas cerca de 13% dos distúrbios de hemostasia são reconhecidos aqui e uma sensação de falsa segurança é criada para os médicos. Os distúrbios de coagulação que são mais comuns epidemiologicamente e afetam a função plaquetária ou o fator de Von Willebrand não são registrados pelos três testes padrão, de modo que só é recomendado se houver um histórico de sangramento positivo. Outros autores consideram isso negligente e recomendam a determinação pré-operatória rotineira de contagem de plaquetas, tempo de tromboplastina parcial ativada (aPTT), valor de Quick e fibrinogênio, mesmo com história de sangramento negativa, para que novos estudos pareçam necessários.
O sangue arterial coagula mais rápido do que o sangue venoso, o que se deve às diferenças no conteúdo gasoso. A coagulação do sangue arterial pode ser retardada pela adição de ácido carbônico , mas a do sangue venoso pode ser acelerada pelo aumento de seu conteúdo de oxigênio . As diferenças na temperatura dos dois tipos de sangue são muito menos regulares, porque, embora em órgãos com um metabolismo muito ativo (por exemplo, glândulas e músculos), o sangue que flui é mais quente do que o sangue que entra, órgãos com capacidade apenas insignificante de geração de calor ( por exemplo, a pele externa) mostram o comportamento oposto.
Significado em doenças
Basicamente, o equilíbrio entre a hemostasia e a fibrinólise pode prejudicar as duas direções: o aumento da coagulação é chamado de trombofilia (os coágulos sanguíneos que se desenvolvem e causam a doença são chamados de trombo ou embolia ), e a coagulação reduzida é a diátese hemorrágica . Uma tendência ao sangramento também pode surgir como resultado de uma forte ativação de coagulação prévia com consumo de fatores de coagulação.
Tendência de sangramento
Os processos fisiológicos acima descritos de hemostasia após uma lesão (vasos sanguíneos, hemostasia celular e plasmática) podem ser perturbados em qualquer fase, de modo que uma série de distúrbios diferentes podem cada um levar a uma tendência a sangrar. Como a própria hemostasia, seus distúrbios podem começar na área dos vasos sanguíneos. Por exemplo, uma malformação congênita dos vasos sanguíneos, que leva ao seu aumento e é conhecida como doença de Osler , pode ser a causa de um aumento da tendência ao sangramento.
A hemostasia celular é prejudicada quando há uma falta pronunciada de plaquetas sanguíneas ( trombocitopenia ) ou quando há disfunção das plaquetas sanguíneas. Os últimos são a causa mais comum de aumento da tendência a sangrar. Eles podem ser causados por medicamentos (consulte a seção Antiagregantes plaquetários acima), o distúrbio congênito mais comum da hemostasia celular (e ao mesmo tempo o distúrbio hemorrágico congênito mais comum de todos) é a síndrome de Willebrand-Jürgens .
A falta de muitos fatores de coagulação plasmática também pode levar a doenças que às vezes são fatais, por exemplo, doenças hereditárias como a hemofilia . Isso afeta mais comumente o fator de coagulação VIII (hemofilia A), menos frequentemente também o fator de coagulação IX (hemofilia B).
Além das formas congênitas de tendência ao sangramento, que geralmente são causadas por defeitos genéticos em componentes individuais da hemostasia, também existem condições adquiridas que levam a um aumento da tendência ao sangramento. A coagulação plasmática pode, por. B. ser prejudicado por uma deficiência de vitamina K. Como resultado, os fatores de coagulação II, VII, IX e X não podem mais ser suficientemente carboxilados no fígado , o que pode levar a uma deficiência funcional e, conseqüentemente, a hemorragia cerebral grave, especialmente em bebês prematuros. Uma vez que todos os fatores de coagulação são produzidos no fígado, as doenças hepáticas graves quase sempre levam à falta de fatores de coagulação com a consequência de um risco aumentado de sangramento.
Uma coagulopatia intravascular disseminada é uma doença com risco de vida em que o próprio corpo, por mediadores de nível anormalmente alto, como histamina, serotonina e adrenalina, ocorre uma coagulação sanguínea excessivamente drenante. Isso leva a um alto consumo de fatores de coagulação plasmática, que o corpo não consegue repor com a rapidez necessária. Fala-se, portanto, de uma coagulopatia de consumo.
As transfusões de plasma profiláticas podem ser usadas antes da cirurgia em pacientes com um distúrbio hemorrágico. Em relação ao efeito das transfusões de plasma profiláticas antes de procedimentos invasivos em pacientes sem distúrbios hemorrágicos congênitos, as evidências para mortalidade por todas as causas, para sangramento maior, para o número de transfusões por paciente, para o número de pacientes que requerem uma transfusão e para transfusão complicações relacionadas é muito incerto. Diferentes gatilhos de transfusão para plasma fresco congelado (FFP) podem permitir uma redução no número de pessoas que precisam dessa transfusão.
Trombose e embolia
A trombose é uma doença vascular em que um coágulo sanguíneo (trombo) se forma em um vaso. As causas para isso podem ser encontradas em danos à parede vascular e geralmente na redução do fluxo sanguíneo. No entanto, os distúrbios da coagulação também desempenham um papel importante aqui: por exemplo, um aumento da tendência hereditária ou induzida por drogas para coagular pode rapidamente levar à trombose. Por esse motivo, contramedidas como meias de profilaxia de trombose médica (MTPS) , compressão pneumática intermitente ou anticoagulantes como heparina ou fenprocumom devem ser tomadas, por exemplo, mesmo se as pernas ficarem imobilizadas por um longo tempo.
Uma embolia é um trombo que foi lavado de seu local de origem. Isso pode levar a complicações graves, incluindo um infarto cerebral .
Trombofilia
Existem várias doenças congênitas e adquiridas nas quais há um aumento da tendência à coagulação. O que todos eles têm em comum é o aumento da oclusão vascular, como trombose e embolia . Em algumas doenças, o sistema de alta pressão das artérias (artérias) é mais afetado, em outras o sistema de baixa pressão das veias. As trombofilias mais comuns e importantes são:
- Doença do fator V (mais de 90 por cento da causa da resistência a APC )
- Mutação da protrombina G20210A
- Síndrome Antifosfolipídica
- Deficiência de inibidores da coagulação, especialmente deficiência de proteína C , deficiência de proteína S e deficiência de antitrombina
- aumento de homocisteína
- aumento do fator VIII de coagulação.
Uma forma especial de trombofilia pode ocorrer durante o tratamento com o anticoagulante heparina . Essa droga, paradoxalmente, em alguns casos ativa as plaquetas, fazendo com que se aglutinem e iniciem a cascata de coagulação. Isso pode causar trombose grave em todo o corpo. A diminuição do número de plaquetas sanguíneas pode ser medida, por isso o quadro clínico é denominado trombocitopenia induzida por heparina (tipo II).
Veja também
- Hemostasia para outros métodos de hemostasia médica
literatura
- Joachim Rassow , Karin Hauser, Roland Netzker: Bioquímica . 1ª edição. Thieme, Stuttgart 2006, ISBN 3-13-125351-7 .
- Werner Müller-Esterl: Bioquímica. Uma introdução para médicos e cientistas . 1ª edição. Spectrum Academic Publishing House, Frankfurt 2004, ISBN 3-8274-0534-3 .
- Roland Scholz: Medical Biochemistry . 1ª edição. Capítulo 11/12: Biotransformação: substâncias estranhas, heme, colesterol. Coagulação do sangue e fibrinólise. Zuckerschwerdt, Munich 2003, ISBN 3-88603-822-X .
- Robert F. Schmidt, Florian Lang, Gerhard Thews : Human physiology . 29ª edição. Springer, Berlin 2004, ISBN 3-540-21882-3 .
- Monika Barthels, Mario von Depka: O compêndio de coagulação . 1ª edição. Thieme, Stuttgart 2003, ISBN 3-13-131751-5 .
- Herbert A. Neumann: O sistema de coagulação: Fisiologia e fisiopatologia. Uma introdução . 1ª edição. ABW Wissenschaftsverlag, Berlin 2007, ISBN 3-936072-66-3 .
- Samuel C. Harvey: A história da hemostasia. In: Annales de história médica. Neue Episode, 1, 1929, pp. 127-134.
Links da web
- Axel W. Bauer , Kerstin Mall: Hemostasis, Thrombosis and Embolism. Conceitos históricos sobre a fisiologia da coagulação do sangue ( Memento de 4 de março de 2010 no Arquivo da Internet ), Universidade de Heidelberg. Publicado em Hemostaseology . 15 (1995) 92-99.
- Coagulação Sanguínea (Inglês)
Evidência individual
- ↑ Gerd Herold : Medicina Interna. Publicado pelo próprio, Cologne 2018, p. 135.
- ↑ Ulrich Weber: Biologia. Volume completo Oberstufe, Cornelsen, Berlin 2001, ISBN 3-464-04279-0 , página 153.
- ↑ J. Poeira de areia: Estrutura e função dos vasos sanguíneos . In: anatomia de Benninghoff . 15ª edição. Urban & Springer, Munique 1994.
- ^ Robert F. Schmidt, Florian Lang, Gerhard Thews: Physiologie des Menschen . 29ª edição. Springer, Berlin 2004, ISBN 3-540-21882-3 , pp. 524 .
- ↑ Coagulação (ões) de sangue
- ^ Rainer Klinke, Hans-Christian Pape, Stefan Silbernagl (eds.): Textbook of Physiology. 5ª edição. Thieme, Stuttgart 2005, ISBN 3-13-796003-7 ; P. 246 f.
- ↑ Deetjen, Speckmann, Hescheler: Physiology . 4ª edição. Urban & Fischer, Munich 2006, ISBN 3-437-44440-9 , pp. 366 .
- ^ Earl W. Davie, Kazuo Fujikawa, Walter Kisiel: A cascata de coagulação: iniciação, manutenção e regulação . In: Biochemistry, 1991, 30 (43), 10363-10370.
- ^ Joachim Rassow, Karin Hauser, Roland Netzker: Bioquímica . 1ª edição. Thieme, Stuttgart 2006, ISBN 3-13-125351-7 , pp. 742 .
- ↑ A Cell-based Model of Hemostasis, Maureane Hoffman, Dougald M. Monroe III, Thromb Haemost 2001; 85: 958-65 © 2001 Schattauer GmbH, Stuttgart, PMID 11434702 .
- ↑ O papel central das plaquetas na nova compreensão da hemostasia, K. Jurk, BE Kehrel, Hämostaseologie 2005; 25: 39-49 Schattauer GmbH, Stuttgart.
- ↑ F. Josso, O. Prou-Wartelle: Interação do fator de tecido e fator VII na primeira fase da coagulação. In: Trombose e diátese hemorrágica. Suplemento. Volume 17, 1965, ISSN 0375-9997 , pp. 35-44, PMID 5874847 .
- ↑ a b c d Wolf-Dieter Müller-Jahncke , Christoph Friedrich , Ulrich Meyer: história medicinal . 2., revisado. e exp. Edição. Conhecimento Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5 , pp. 116 .
- ↑ a b Axel W. Bauer , Kerstin Mall: hemostasia, trombose e embolia. Conceitos históricos sobre a fisiologia da coagulação do sangue ( Memento de 4 de março de 2010 no Arquivo da Internet ), Universidade de Heidelberg. Publicado em Hemostaseology . 15 (1995) 92-99.
- ↑ RJ Jenny, DD Pittman, JJ Toole, RW Kriz, RA Aldape, RM Hewick, RJ Kaufman, KG Mann: cDNA completo e sequência de aminoácidos derivada do fator humano V. In: Proc Natl Acad Sci USA , 1987, 84, p 4846-4850, PMID 3110773 .
- ^ RA Biggs, AS Douglas, RG MacFarlane, JV Dacie, WR Pittney, C. Merskey e JR O'Brien: Christmas disease, a condição previamente confundida com hemofilia. Em: British Medical Journal , Londres, 1952, pp. 1378-1382.
- ^ Physiology of Coagulation ( Memento desde 15 de setembro de 2011 no Internet Archive ) Instituto Werlhof.
- ↑ Comunicado à imprensa do FDA de 5 de novembro de 2007 .
- ↑ Günter Thiele (ed.): Handlexikon der Medizin , Urban & Schwarzenberg, Munich / Vienna / Baltimore no ano, Volume II (F - K), página 1328.
- ^ Lexicon Medicine , 4ª edição, Elsevier Verlag, Munich without year [2005], ISBN 3-625-10768-6 , página 920.
- ^ B. Luxembourg e outros: Conhecimento básico do laboratório de coagulação . In: Deutsches Ärzteblatt 104, edição 21, 25 de maio de 2007, página A-1489.
- ^ J. Koscielny e outros: Identificação pré - operatória de pacientes com desordens de hemostasis (primárias). In: Hamostaseologie , 27 de agosto de 2007 (3), pp. 177-184, PMID 17694224 .
- ↑ G. Pfanner et al.: História de sangramento pré - operatório . In: Anaesthesist , junho de 2007 56 (6), pp. 604-611. doi : 10.1007 / s00101-007-1182-0 , PMID 17522829 .
- ↑ C. Bidlingmaier et al.: Teste hemostático antes de cirurgia eletiva em crianças? Nem sempre! In: Hamostaseologie , 29 de janeiro de 2009 (1), pp. 64-67 , PMID 19151849 .
- ^ FW Albert e outros: Análise laboratorial de uma diátese hemorrágica antes da cirurgia eletiva? Sim! . ( Memento do originais de 27 abr 2015 na Internet Archive ) Info: O arquivo de ligação foi inserido automaticamente e ainda não foi marcada. Verifique o link original e o arquivo de acordo com as instruções e, em seguida, remova este aviso. In: Hamostaseologie , 29 de janeiro de 2009 (1), pp. 58-63.
- ↑ Jonathan Huber, Simon J. Stanworth, Carolyn Doree, Patricia M. Fortin, Marialena Trivella: Transfusão de plasma profilática para pacientes sem distúrbios hemorrágicos hereditários ou uso de anticoagulante submetidos a cirurgia não cardíaca ou procedimentos invasivos . In: Cochrane Database of Systematic Reviews . 28 de novembro de 2019, doi : 10.1002 / 14651858.CD012745.pub2 ( wiley.com [acessado em 25 de agosto de 2020]).