glicose
| Fórmula estrutural | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
|
D- glicose (esquerda) e L- glicose (direita)
Projeção Fischer , representação de cadeia aberta | |||||||||
| Em geral | |||||||||
| Sobrenome | glicose | ||||||||
| outros nomes |
|
||||||||
| Fórmula molecular | C 6 H 12 O 6 | ||||||||
| Descrição breve |
D- glicose: |
||||||||
| Identificadores / bancos de dados externos | |||||||||
| |||||||||
| Informação sobre drogas | |||||||||
| Código ATC | |||||||||
| propriedades | |||||||||
| Massa molar | 180,16 g mol −1 | ||||||||
| Estado físico |
fixo |
||||||||
| densidade |
1,562 g cm -3 |
||||||||
| Ponto de fusão | |||||||||
| solubilidade |
bom na água (470 g l -1 a 20 ° C) |
||||||||
| instruções de segurança | |||||||||
| |||||||||
| Dados toxicológicos | |||||||||
| Tanto quanto possível e usual, unidades SI são usadas. Salvo indicação em contrário, os dados fornecidos aplicam-se às condições padrão . | |||||||||
Glicose (abreviatura: Glc ) ou glicose (do grego γλυκύς 'doce' e -ose como um sufixo para açúcar) é um carboidrato que ocorre naturalmente . Dos enantiômeros da glicose , a D- glicose é a forma natural. É também conhecido como glicose ou ingredientes alimentares como a chamada dextrose e é o monossacarídeo mais abundante (açúcar simples). A L- glicose pode ser representada sinteticamente, mas é de pouca importância (para uma explicação das designações “ D ” e “ L ”, veja a projeção de Fischer ). Se a glicose for mencionada sem qualquer nome adicional ( prefixo ), significa D- glicose .
Nos organismos vivos, a glicose é a principal fonte de energia. É armazenado como glucano polimérico , em animais como glicogênio e em plantas como amido . Como componente da celulose , é o principal componente das paredes celulares das plantas e, portanto, o carboidrato mais comum. A glicose é usada em soluções de infusão médica e é considerada um medicamento essencial .
história
A glicose foi isolada pela primeira vez de passas por Andreas Sigismund Marggraf em 1747 . Foi isolado da uva por Johann Tobias Lowitz em 1792 e reconhecido como diferente do açúcar de cana ( sacarose ). Glicose é o termo cunhado por Jean Baptiste Dumas em 1838, que se consagrou na literatura química. Por Friedrich August Kekule dextrose proposta vem (do latim dexter = direita), como glicose em solução aquosa o plano de luz polarizada linearmente para a direita gira. Em contraste, D - frutose (uma cetohexose ) e L- glicose giram luz polarizada linearmente para a esquerda . A nomenclatura d e l anterior com base nisso foi abandonada em favor da notação D e L , que se refere à configuração absoluta do centro assimétrico mais distante do grupo carbonila, e aquela das correspondências D ou L- gliceraldeído.
A estrutura da glicose e as relações estruturais com os outros monossacarídeos foram descritas por Emil Fischer entre 1891 e 1894 com a ajuda da projeção de Fischer e representaram um marco na química de produtos naturais , pelo qual ele recebeu o Prêmio Nobel de Química em 1902 . Sua primeira síntese bem-sucedida de glicose confirmou as teorias de Jacobus Henricus van 't Hoff sobre o arranjo tetraédrico de ligações químicas em compostos de carbono orgânico e sobre a cinética química . O conhecimento assim obtido tornou possível introduzir uma nomenclatura sistemática para carboidratos estereoisoméricos usando nomes convencionais com referência à sua simetria espacial (por exemplo, nomenclatura de Fischer, nomenclatura D / L ).
Otto Meyerhof recebeu o Prêmio Nobel de Fisiologia ou Medicina em 1922 por sua descoberta do metabolismo da glicose . Hans von Euler-Chelpin , junto com Arthur Harden, recebeu o Prêmio Nobel de Química em 1929 por suas pesquisas sobre "a fermentação do açúcar e como as enzimas contribuem para esse processo". Em 1947, Carl e Gerty Cori receberam o Prêmio Nobel de Fisiologia ou Medicina pela descoberta da reciclagem do ácido lático produzido no músculo pela glicólise para gliconeogênese e síntese de glicogênio no fígado, e Bernardo Houssay pela descoberta do papel dos hormônios hipofisários no metabolismo da glicose. Luis Leloir recebeu o Prêmio Nobel de Química em 1970 por sua descoberta dos nucleotídeos de açúcar formados a partir da glicose durante a biossíntese de carboidratos .
propriedades
A glicose está geralmente na forma sólida como um anel pirano fechado mono- hidrato ( Hidratdextrose ). Em solução aquosa, por outro lado, é de cadeia aberta em pequena extensão e está predominantemente na forma de α- ou β-piranose, algumas das quais se fundem por mutarotação. As três formas conhecidas podem ser cristalizadas a partir de soluções aquosas: α-glucopiranose, β-glucopiranose e hidrato de β-glucopiranose. A glicose é um componente do açúcar duplo lactose (açúcar do leite), sacarose (açúcar de cana ou beterraba) e maltose , bem como açúcares múltiplos , como rafinose, e açúcares múltiplos , como amido e amilopectina , glicogênio e celulose . A temperatura de transição vítrea da glicose é 31 ° C e a constante de Gordon-Taylor (uma constante determinada experimentalmente para prever a temperatura de transição vítrea em diferentes frações de massa de uma mistura de duas substâncias) é 4,5.
A glicose é provavelmente o monossacarídeo natural mais comum porque reage menos com as proteínas por meio da glicação do que outros monossacarídeos. Outra hipótese é que com a glicose na forma de β- D- glicose como a única D -aldohexose, todos os cinco substituintes hidroxi estão na posição equatorial e são, portanto, mais facilmente acessíveis para reações químicas, por exemplo, para esterificação ou formação de acetal. Por esse motivo, a D- glicose também é o bloco de construção mais preferido em polissacarídeos naturais (glicanos).
Sistemática de glicose
| Diferentes formas e representações de D- glicose em comparação | ||
|---|---|---|
| Fórmula de cunha | Notação de Haworth | |

|
 α- D- glucofuranose |
 β- D- glucofuranose |
 α- D- glucopiranose |
 β- D- glucopiranose |
|
| α- D- glucopiranose em (1) Tollens / Fischer (2) Haworth (3) representação de poltrona (4) visão estereoquímica | ||

| ||
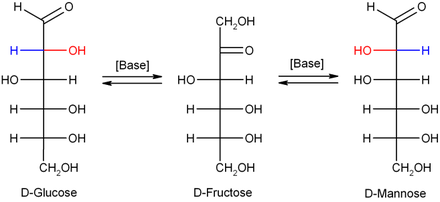
A representação do α- mostrado acima D- glicose como α- D- glicopiranose, ver 2 é, além disso, sua projeção de Haworth chamada e o anel recém-formado como desenhado neste diagrama para simplicidade (que pode não corresponder à realidade, para muitos propósitos, mas é suficiente). Como resultado do fechamento do anel, o primeiro átomo de carbono torna-se um novo centro quiral adicional , com o resultado de que um par de anômeros é possível - açúcares estereoisoméricos que diferem apenas na configuração em seu centro quiral recém-formado durante o fechamento do anel e, portanto, um caso especial São epímeros .
A estrutura na qual o grupo OH recém-criado do hemiacetal aponta "para baixo" em sua projeção de Haworth (axialmente) é referida como α- D -glicose, que com o grupo OH (equatorial) "para cima" apontando como β- D - glicose. Em geral, no caso de açúcares anoméricos α, o grupo OH recém-formado quando o anel se fecha está na projeção de Haworth no lado do plano do anel oposto ao grupo CH 2 OH terminal , enquanto na forma β está no mesmo lado. A propósito, esta definição também se aplica da mesma forma a todos os outros açúcares D e L , bem como - desde que o grupo CH 2 OH terminal também não esteja aqui, tal como, e. B. na frutopiranose , parte do fechamento do anel - tanto para aldoses quanto para cetoses.
A projeção de Fischer é confusa para as formas hemiacetais cíclicas, consulte 1 . A fim de esclarecer o arranjo angular da cadeia de carbono, a representação da poltrona 3 é selecionada. A representação 4 também é comum e estereoquimicamente inequívoca.
Comportamento em solução aquosa

O anel pode ser aberto e fechado em solução aquosa para que haja um equilíbrio entre a piranose (anel de seis membros com átomo de oxigênio endocíclico, 99,75%), a forma de furanose (anel de cinco membros, em traços) e a forma de aldeído de cadeia aberta ( 0,25%). A adição de ácido ou soda cáustica acelera esse processo. Uma vez que a forma alfa ou beta pode surgir durante o fechamento do anel, há também um equilíbrio entre a forma alfa (36%) e a forma beta (63,9%). O saldo está, como pode ser visto nas porcentagens, do lado da β- D- glicose. É o anômero mais estável , uma vez que todos os grupos hidroxila na conformação da cadeira são dispostos equatorialmente e, portanto, têm a maior distância possível uns dos outros. O fato de que 36% do anômero α ainda está presente apesar de seu grupo OH axial indica outras influências ( efeito anomérico ). Sem o efeito anomérico, haveria uma proporção de 11% da forma α para 89% da forma β.
Mutarotação
A conversão entre os dois anômeros pode ser observada no polarímetro porque a α- D- glicose pura um ângulo específico de rotação de + 112,2 ° · ml · dm -1 · g -1 , tem β- D- glicose pura de +17 , 5 ° ml dm −1 g −1 . Se o equilíbrio foi estabelecido após certo tempo, existe um ângulo de rotação de + 52,7 ° · ml · dm - 1 · g - 1 . Essa mudança no ângulo de rotação é conhecida como mutarrotação . Esta conversão pode ser acelerada massivamente pela adição de ácido ou base . O equilíbrio é estabelecido por meio da forma de aldeído de cadeia aberta.

Isomerização
Em solução diluída de hidróxido de sódio, manose , glicose e frutose são convertidas umas nas outras ( rearranjo de Lobry-de-Bruyn-Alberda-van-Ekenstein ), de modo que se forma um equilíbrio entre esses isômeros . Esta reação ocorre por meio de um enodiol :
Auxiliares de memória para estereoquímica
Para lembrar a configuração da glicose na projeção de Fischer, existe a seguinte ponte de burro : As posições dos grupos hidroxila à direita e à esquerda da cadeia de carbono podem ser "simbolizadas" pela onomatopeia do som de uma trompa de martin ("Ta-Tü-Ta-Ta"). O arranjo dos grupos hidroxila na galactose , por outro lado, pode ser lembrado como luz azul (veja a ilustração).
Você pode usar a palavra "HochBett" (B para beta) para lembrar qual forma de glicose está presente. Se o grupo hidroxila C-1 está no topo ("alto") na projeção de Haworth, então é a forma beta ("leito").
Ocorrência
A glicose ocorre em todos os seres vivos porque é um componente central do metabolismo de todos os seres vivos.
| Comida | Carboidratos totais incluindo fibras |
Açúcar total | Frutose | glicose | Sacarose | Razão de
frutose / glicose |
Sacarose em% do açúcar total |
|---|---|---|---|---|---|---|---|
| fruta | |||||||
| maçã | 13,8 | 10,4 | 5,9 | 2,4 | 2,1 | 2.0 | 19,9 |
| Damasco | 11,1 | 9,2 | 0.9 | 2,4 | 5,9 | 0,7 | 63,5 |
| banana | 22,8 | 12,2 | 4,9 | 5.0 | 2,4 | 1.0 | 20,0 |
| Figo , seco | 63,9 | 47,9 | 22,9 | 24,8 | 0.9 | 0,93 | 0,15 |
| Uvas | 18,1 | 15,5 | 8,1 | 7,2 | 0,2 | 1,1 | 1 |
| Laranja umbilical | 12,5 | 8,5 | 2,25 | 2.0 | 4,3 | 1,1 | 50,4 |
| pêssego | 9,5 | 8,4 | 1,5 | 2.0 | 4,8 | 0.9 | 56,7 |
| pera | 15,5 | 9,8 | 6,2 | 2,8 | 0,8 | 2,1 | 8,0 |
| abacaxi | 13,1 | 9,9 | 2,1 | 1,7 | 6,0 | 1,1 | 60,8 |
| ameixa | 11,4 | 9,9 | 3,1 | 5,1 | 1,6 | 0,66 | 16,2 |
| legumes | |||||||
| Beterraba | 9,6 | 6,8 | 0,1 | 0,1 | 6,5 | 1.0 | 96,2 |
| cenoura | 9,6 | 4,7 | 0,6 | 0,6 | 3,6 | 1.0 | 77 |
| colorau | 6,0 | 4,2 | 2,3 | 1,9 | 0,0 | 1,2 | 0,0 |
| cebola | 7,6 | 5.0 | 2.0 | 2,3 | 0,7 | 0.9 | 14,3 |
| batata doce | 20,1 | 4,2 | 0,7 | 1.0 | 2,5 | 0.9 | 60,3 |
| inhame | 27,9 | 0,5 | vestígios | vestígios | vestígios | - | vestígios |
| Cana de açúcar | 13-18 | 0,2-1,0 | 0,2-1,0 | 11-16 | 1.0 | Alto | |
| beterraba sacarina | 17-18 | 0,1-0,5 | 0,1-0,5 | 16-17 | 1.0 | Alto | |
| grão | |||||||
| Milho | 19,0 | 6,2 | 1,9 | 3,4 | 0.9 | 0,61 | 15.0 |
Produção industrial
A glicose é produzida industrialmente a partir do amido por hidrólise enzimática usando amilase de glicose ou usando ácidos , a hidrólise enzimática tendo amplamente substituído a hidrólise catalisada por ácido. Isso resulta em xarope de glicose (enzimaticamente com mais de 90% de glicose na matéria seca) com um volume de produção mundial anual de 20 milhões de toneladas (em 2011). É aqui que o nome "açúcar de amido" era usado no passado. Milho , batata , arroz , trigo , centeio , mandioca , batata-doce e sagu são usados como fontes de amido . As amilases vêm principalmente de Bacillus licheniformis ou Bacillus subtilis (cepa MN-385), que são mais termoestáveis do que as enzimas usadas anteriormente. A partir de 1982, pululanases de Aspergillus niger foram usadas na produção de xarope de glicose para converter amilopectina em amilose, aumentando assim o rendimento de glicose. A reação é realizada a um pH de 4,6-5,2 e uma temperatura de 55-60 ° C. O xarope de milho possui entre 20% e 95% de glicose na matéria seca. A forma japonesa de xarope de glicose Mizuame é feita de batata-doce ou amido de arroz. A maltodextrina contém cerca de 20% de glicose.
Conversão para frutose
Nos EUA , o milho é usado quase exclusivamente com a ajuda de amilase e glicose isomerase para produzir a doçura alimentar isoglicose , que é uma mistura de glicose e frutose (também xarope de milho com alto teor de frutose HFCS). A frutose tem uma doçura mais alta do que a glicose, com o mesmo valor calorífico fisiológico de 374 quilocalorias por 100 g. A produção mundial anual de isoglicose é de oito milhões de toneladas (em 2011).
Uso industrial
Acima de tudo, a glicose é usada na produção de frutose e na produção de alimentos que contêm glicose . Na alimentação, é usado como adoçante , umectante , para aumentar o volume e criar uma sensação na boca mais suave . Várias fontes de glicose, como suco de uva (para vinho) ou malte (para cerveja), são usadas para fermentar em etanol no curso da produção de bebidas alcoólicas . A maioria dos refrigerantes nos EUA usa HFCS-55 (ou seja, 55% de frutose), enquanto a maioria dos outros alimentos adoçados com HFCS nos EUA usam HFCS-42. Já no vizinho México , o açúcar de cana é usado como adoçante no refrigerante Coca-Cola , que tem maior poder adoçante. O xarope de glicose também é utilizado na produção de doces , como balas , caramelo e fondant . As reações químicas típicas da glicose nas técnicas de cozimento a seco são a caramelização e, com aminoácidos, a reação de Maillard .
A glicose é adequada como substrato para fermentação industrial , por exemplo com Clostridium thermoaceticum para a produção de ácido acético , com Penicillium notatum para a produção de ácido araboascórbico , com Rhizopus delemar para a produção de ácido fumárico , com Aspergillus niger para a produção de glucônico ácido , com Candida brumptii para a produção de ácido isocítrico , com Aspergillus terreus para a produção de ácido itacônico , com Pseudomonas fluorescens para a produção de ácido 2-ceto glucônico , com Gluconobacter suboxydans para a preparação de ácido 5-cetoglucônico , com Aspergillus oryzae para a preparação de ácido kójico com Lactobacillus delbruckii para a preparação de ácido láctico , com Lactobacillus brevis para a preparação de ácido málico , com Propionibacter shermanii para produzir ácido propiônico , com Pseudomonas aeruginosa para produzir ácido pirúvico e com Gluconobacter suboxydans para produzir ácido tartárico .
O quadro a seguir oferece uma breve visão geral de produtos importantes que podem ser produzidos biotecnologicamente. Os produtos de interesse industrial e seus estágios preliminares estão marcados em negrito :
A partir da celulose, a enzima celulase é utilizada para produzir glicose para a produção de etanol ( celulose-etanol ) para uso como biocombustível .
bioquímica
A glicose é produzida principalmente pelas plantas com a ajuda da fotossíntese da luz solar, água e dióxido de carbono e pode ser usada por todos os seres vivos como fonte de energia e carbono. Grande parte da glicose em plantas e animais não é livre, mas sim na forma ligada, por exemplo na forma de lactose ou açúcar de beterraba (sacarose) , ou na forma de polímeros , como amido ou celulose, que são substâncias ou componentes de reserva da parede celular das plantas . Esses polímeros são primeiro quebrados em glicose com a ajuda de enzimas quando animais, fungos e bactérias os comem . Em humanos, isso às vezes acontece ao mastigar com amilase, que está contida na saliva , e com maltase . Todos os seres vivos também são capazes de produzir glicose a partir de certos materiais iniciais, se necessário. As células nervosas , as células da medula renal e os eritrócitos dependem da glicose para sua produção de energia. No ser humano adulto, há cerca de 18 g de glicose, dos quais cerca de 4 g estão no sangue. Aproximadamente 180 a 220 g de glicose são formados no fígado de um ser humano adulto em 24 horas.
Precursores de outras biomoléculas
Nos seres vivos, a glicose é convertida em vários outros compostos químicos que são o produto inicial de várias vias metabólicas. Todos os outros monossacarídeos, como a frutose (pela via do poliol ), a manose (o epímero na posição 2), a galactose (o epímero na posição 4), a fucose , vários ácidos urônicos e os amino açúcares são produzidos a partir da glicose . Além da fosforilação em glicose-6-fosfato , que faz parte da glicólise , a glicose pode inicialmente ser oxidada em glucono-1,5-lactona quando é decomposta . Em algumas bactérias, a glicose serve como um bloco de construção na biossíntese de trealose ou dextrana e em animais como um bloco de construção para o glicogênio. A glicose também pode ser convertida em frutose pela xilose isomerase bacteriana . Além disso, todos os aminoácidos não essenciais , álcoois de açúcar como manitol e sorbitol , ácidos graxos , colesterol e ácidos nucléicos são produzidos a partir dos produtos metabólicos da glicose . Finalmente, a glicose é usada como um componente na glicosilação em glicoproteínas necessárias para a função de muitas proteínas e também em outras substâncias glicosiladas, como glicolipídeos , peptidoglicanos e glicosídeos . A glicosilação é catalisada por glicosiltransferases e pode ser novamente separada por glicosidases .
gravação
Em humanos, a glicose ingerida dos alimentos primeiro se liga ao receptor do sabor doce na língua. Este complexo de proteínas T1R2 e T1R3 permite identificar fontes de alimentos contendo glicose. A glicose vem principalmente dos alimentos - cerca de 300 g por dia é produzida pela conversão dos alimentos, mas também é sintetizada a partir de outros metabólitos nas células do corpo. A glicose é um componente de muitos carboidratos e pode ser separada deles com a ajuda de certas enzimas . As glicosidases (um subgrupo de glicosidases) catalisam primeiro a hidrólise de polissacarídeos contendo glicose de cadeia longa, com a glicose terminal sendo removida. Os dissacarídeos, por sua vez, são decompostos em glicose por glicosidases especiais . Os nomes das enzimas degradantes são freqüentemente derivados dos respectivos poli e dissacarídeos; Por exemplo, existem amilases (da amilose , parte do amido ), celulases (da celulose ), quitinases (da quitina ) e mais para a quebra de cadeias de polissacarídeos ; Além disso, para a clivagem de dissacarídeos a lactase , sacarase , trealase e outros. Cerca de 70 genes são conhecidos em humanos que codificam para glicosidases. Eles têm funções na digestão e na quebra de glicogênio, esfingolipídeos , mucopolissacarídeos e poli (ADP-ribose) . Nos seres humanos, polissacáridos contendo glicose são parcialmente quebrada durante a mastigação por amilase , que está contida na saliva , e por maltase , lactase e sacarase na borda em escova do intestino delgado .
Para entrar ou sair das células e dos compartimentos celulares através da membrana celular , a glicose precisa de proteínas especiais de transporte da superfamília dos principais facilitadores . No intestino delgado (mais precisamente no jejuno ), a glicose é absorvida pelas células epiteliais intestinais com o auxílio do transportador de glicose por meio de um mecanismo de transporte ativo secundário denominado simporte íon-glicose de sódio ( cotransportador 1 de sódio / glicose ) . É transmitido no lado basolateral da célula epitelial intestinal através do transportador de glicose GLUT2 , assim como sua captação nos hepatócitos , células renais , células β das ilhotas de Langerhans, neurônios, astrócitos e tanicitos . A glicose chega ao fígado pela veia porta e é armazenada lá na forma de glicogênio. Na célula do fígado, ele é fosforilado em glicose-6-fosfato pela glucoquinase na posição 6 ; então ela não pode mais sair da cela. Com a ajuda da glicose-6-fosfatase , a glicose-6-fosfato é novamente convertida em glicose, se necessário, exclusivamente no fígado, de modo que esteja disponível para manter uma concentração sanguínea suficiente. Em outras células, a absorção ocorre por meio de transporte passivo através de uma das 14 proteínas GLUT. Nos outros tipos de células , a fosforilação é realizada por uma hexoquinase , após o que a glicose não pode mais se difundir para fora da célula.
O GLUT1 é formado pela maioria dos tipos de células e tem um significado especial para as células nervosas e para o pâncreas contendo células β . O GLUT3 geralmente é formado por células nervosas. A glicose da corrente sanguínea é absorvida pelas células musculares (músculos esqueléticos e cardíacos) e pelas células de gordura via GLUT4 . O GLUT14 é produzido apenas em testículos . O excesso de glicose ingerida é decomposto e convertido em ácidos graxos, que são armazenados como triacilglicerídeos . Nos rins, a glicose é absorvida da urina via SGLT1 e SGLT2 nas membranas celulares apicais e transmitida via GLUT2 nas membranas celulares basolaterais. Cerca de 90% da absorção de glicose do rim ocorre via SGLT2 e cerca de 3% via SGLT1.
biossíntese
A via metabólica para a construção da glicose a partir de pequenas moléculas de dois a quatro átomos de carbono, que termina na molécula de glicose com seis átomos de carbono, é chamada de gliconeogênese e ocorre em todos os seres vivos. Por meio da gliconeogênese, o organismo pode acumular glicose a partir de outros produtos metabólicos, incluindo lactato ou certos aminoácidos, enquanto consome energia. Os materiais iniciais menores são o resultado de outras vias metabólicas e, nas plantas, em última análise, vêm da assimilação do dióxido de carbono . Em última análise, quase todas as biomoléculas vêm da assimilação de dióxido de carbono nas plantas durante a fotossíntese. A energia livre de formação da α- D -glicose é de 917,2 quilojoules por mol. Em humanos, a gliconeogênese ocorre no fígado e nos rins , mas também em outros tipos de células . As células tubulares dos rins também podem produzir glicose.
A quebra do glicogênio é conhecida como glicogenólise, a quebra do amido como quebra do amido. Cerca de 150 g de glicogênio são armazenados no fígado e cerca de 250 g nos músculos esqueléticos . A glicose liberada nas células musculares quando o glicogênio é quebrado não pode ser liberada na corrente sanguínea, no entanto, uma vez que a glicose é fosforilada pela hexoquinase, nenhuma glicose-6-fosfatase é formada para remover o grupo fosfato e para a glicose-6-fosfato em contraste com a glicose, nenhuma proteína de transporte existe.
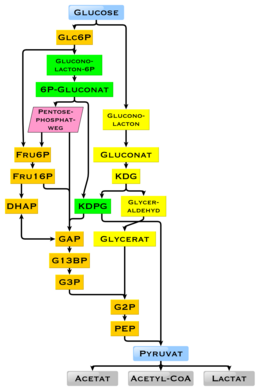
Desmontagem
A glicose é decomposta no metabolismo por meio da glicólise e da via da pentose fosfato. A glicólise é usada por todos os organismos vivos com pequenas variações, e todos os organismos geram energia a partir da quebra dos monossacarídeos. No curso posterior do metabolismo, ele pode ser completamente decomposto em água e dióxido de carbono por meio da descarboxilação oxidativa , do ciclo do ácido cítrico e da cadeia respiratória . Caso não haja oxigênio suficiente disponível, a degradação da glicose ocorre nos animais anaerobicamente para lactato pela fermentação do ácido lático e coloca menos energia. Em mamíferos, o lactato dos músculos chega ao fígado através da corrente sanguínea, onde ocorre a gliconeogênese ( ciclo de Cori ). Outras formas de fermentação ocorrem em outros seres vivos . Quando há um alto suprimento de glicose, o metabólito acetil-CoA também é usado para a síntese de ácidos graxos . A glicose também repõe os estoques de glicogênio do corpo, que são encontrados principalmente no fígado e nos músculos esqueléticos. Esses processos são regulados hormonalmente.
A bactéria Escherichia coli pode crescer em meio nutriente que tem glicose como única fonte de carbono. Em algumas bactérias e - em uma forma modificada - também nas arquéias , a glicose é decomposta pela via de Entner-Doudoroff .
As células tumorais freqüentemente crescem comparativamente rápido e consomem uma quantidade acima da média de glicose via glicólise, o que leva à formação de lactato, o produto final da fermentação em mamíferos, mesmo na presença de oxigênio . Este efeito é conhecido como efeito Warburg . Vários SGLT e GLUT são cada vez mais formados para o aumento da captação de glicose em tumores . Na levedura, em altas concentrações de glicose, mesmo na presença de oxigênio (normalmente leva à respiração , mas não à fermentação), o etanol é produzido pela fermentação. Este efeito é conhecido como efeito Crabtree .
Valor calórico
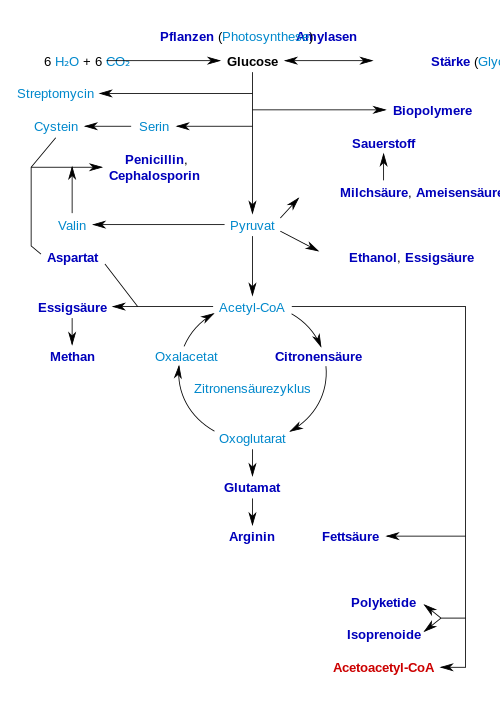
O valor calorífico fisiológico da glicose é, dependendo da fonte, 16,2 quilojoules por grama ou 15,7 kJ / g (3,74 kcal / g). A alta disponibilidade de carboidratos através da biomassa vegetal levou a uma variedade de métodos durante a evolução , especialmente de microrganismos , para utilizar a glicose de armazenamento de energia e carbono. Existem diferenças no produto final a que se chega o produto final que não pode mais ser utilizado para geração de energia. Aqui, a presença de genes individuais e seus produtos gênicos, as enzimas, decidem quais reações são possíveis (veja a figura). A via metabólica da glicólise é usada por quase todos os seres vivos. Uma diferença essencial neste sentido é a produção de NADP como um agente redutor do anabolismo , que de outra forma teria que ser produzido indiretamente.
Concentrações de glicose
A glicose no sangue é chamada de açúcar no sangue . O nível de açúcar no sangue é regulado pelas células nervosas que se ligam à glicose no hipotálamo . Além disso, a glicose no cérebro se liga aos receptores de glicose no centro de recompensa do núcleo accumbens . A ligação da glicose ao receptor do sabor doce na língua desencadeia a liberação de vários hormônios do metabolismo energético com e sem ingestão de glicose, o que leva ao aumento da absorção nas células e à redução do nível de açúcar no sangue. Por outro lado, os adoçantes não reduzem os níveis de açúcar no sangue.
O teor de açúcar no sangue de uma pessoa saudável está em jejum, i. H. após um jejum noturno , cerca de 70 a 100 mg / dl de sangue (4 a 5,5 mM ). Os valores medidos no plasma sanguíneo são cerca de 10-15% maiores. Além disso, os valores no sangue arterial são superiores às concentrações no sangue venoso, uma vez que a glicose é absorvida pelo tecido durante a passagem pelo leito capilar. Também no sangue capilar, que costuma ser usado para determinar os níveis de açúcar no sangue, os valores às vezes são mais elevados do que no sangue venoso. O conteúdo de glicose no sangue é regulado pelos hormônios insulina , incretina e glucagon : a insulina diminui o nível de glicose, o glucagon o aumenta. Além disso, os hormônios adrenalina , tiroxina , glicocorticóides , somatotropina e adrenocorticotropina levam ao aumento do nível de glicose. Há também uma regulação independente de hormônio chamada autorregulação da glicose . Depois de comer, a concentração de açúcar no sangue aumenta. Valores acima de 180 mg / dl no sangue venoso total são patológicos e são chamados de hiperglicemia ; valores abaixo de 40 mg / dl são chamados de hipoglicemia .
Quando usada, a glicose é liberada na corrente sanguínea pela glicose-6-fosfatase da glicose-6-fosfato e do glicogênio do fígado e rins, por meio do qual é alcançada a homeostase da concentração de glicose no sangue. Em ruminantes , a concentração de glicose no sangue é menor (60 mg / dL em bovinos e 40 mg / dL em ovinos) porque os carboidratos são mais convertidos em ácidos graxos de cadeia curta pela flora intestinal .
No cérebro , que depende da glicose como principal fornecedor de energia , a concentração de glicose é normalmente de 4 a 6 mM (5 mM corresponde a 90 mg / dL), mas cai para 2 a 3 mM durante o jejum . Baixas concentrações de glicose no cérebro têm um efeito negativo na capacidade de pensar, autocontrole e vontade . Abaixo de 1mM, ocorre confusão e, abaixo de 1mM, ocorre coma .
O índice glicêmico é um indicador da taxa de absorção e conversão em glicose do sangue a partir dos carboidratos ingeridos e é determinado como a integral do nível de glicose no sangue após a ingestão em comparação com a glicose (a glicose ingerida é definida como 100). O significado clínico do índice glicêmico é controverso, pois alimentos com alto teor de gordura retardam a absorção de glicose e, portanto, reduzem o índice glicêmico, como o sorvete. Uma medida alternativa com o mesmo problema é o índice de insulina , medido como a influência da ingestão de carboidratos no nível de insulina no sangue. A carga glicêmica é um indicador da quantidade de glicose adicionada à corrente sanguínea após a ingestão de carboidratos e é baseada no índice glicêmico e na quantidade de alimento ingerido.
Patobioquímica
Diabetes autoimune
No decorrer de uma reação autoimune contra as células β nas ilhotas de Langerhans no pâncreas , as células β são mortas, o que significa que o hormônio insulina não é mais produzido. Isso dá origem ao diabetes mellitus tipo I (diabetes auto-imune). A insulina ou análogos devem então ser administrados regularmente por injeção subcutânea , dependendo do resultado de uma medição com um medidor de glicose no sangue .
Diabetes adquirida
A desregulação do nível de glicose é referida como hiperglicemia intermediária e, nas formas mais graves, como diabetes mellitus tipo II (sinônimo de diabetes adquirido , resistência à insulina ). Um nível elevado de açúcar no sangue, repetido ou permanente, geralmente indica diabetes mellitus. Dependendo da gravidade, podem ser usados antidiabéticos orais . O exercício regular e evitar a obesidade reduzem o risco de diabetes mellitus tipo II, e o exercício é recomendado para o tratamento de diabetes mellitus tipo II.
Excesso de peso e fígado gorduroso
Além disso, um aumento da ingestão de glicose leva à obesidade e, como resultado, em parte à síndrome metabólica com hepatite hepática gordurosa não alcoólica , mas não ao consumo de glicose no quadro de uma ingestão calórica normal.
Analytics
Especificamente, quando uma molécula de glicose deve ser detectada em uma posição particular em uma molécula maior, uma espectroscopia de ressonância magnética nuclear , uma análise de estrutura de cristal de raios-X ou uma lectina - imunomarcação com uma concanavalina A - enzima repórter - conjugado (apenas liga a glicose ou manose).
Reações de detecção qualitativas clássicas
Essas reações são apenas de significado histórico:
Reação de Fehling
A amostra de Fehling é uma prova clássica de aldoses. Devido à mutação , uma pequena proporção de glicose está sempre presente como um aldeído de cadeia aberta. Ao adicionar os reagentes de Fehling (solução de Fehling (I) e solução de Fehling (II)), o grupo aldeído é oxidado ao ácido carboxílico, enquanto o complexo tartarato de Cu 2+ é reduzido a Cu + e como um precipitado vermelho tijolo (Cu 2 O) falha.
Ótima reação
Com a amostra de Tollens , após adicionar AgNO 3 amoniacal à solução de amostra, o Ag + é reduzido de glicose para prata elementar.
Amostra de Barfoedsche
Na amostra de Barfoed , uma mistura de acetato de cobre dissolvido , acetato de sódio e ácido acético é misturada com a solução do açúcar a ser examinada e aquecida em banho-maria por alguns minutos. A glicose e outros monossacarídeos desenvolvem rapidamente uma cor avermelhada e óxido de cobre (I) marrom-avermelhado (Cu 2 O).
Reagente de Nylander
Como um açúcar redutor , a glicose reage com o reagente de Nylander .
Evidência futura
Quando uma solução diluída de hidróxido de potássio com glicose é aquecida a 100 ° C, ocorre um forte acastanhamento avermelhado e um odor de caramelo. O ácido sulfúrico concentrado dissolve a glicose seca sem enegrecer à temperatura ambiente, com a formação de ácido sulfúrico de açúcar. Em solução com fermento , a fermentação alcoólica produz imediatamente dióxido de carbono em uma proporção de 2,0454 moléculas de glicose para uma molécula de CO 2 . A glicose forma uma massa negra com cloreto de estanho . Na solução amoniacal de prata , a glicose (como lactose e dextrina ) leva à deposição de prata sem a formação de um espelho de prata . Na solução de acetato de chumbo amoniacal , o glicosato de chumbo branco se forma na presença de glicose , que se torna menos solúvel e marrom quando cozido. Na solução de cobre amoniacal, o hidrato de óxido de cobre amarelo é formado com a glicose em temperatura ambiente , enquanto em ebulição, por outro lado, forma o óxido de cobre vermelho (também com a dextrina, exceto para a solução de acetato de cobre amoniacal). Com o reagente de Hager , a glicose forma óxido de mercúrio quando cozinhada . Com uma solução alcalina de bismuto , o bismuto elementar preto-marrom é depositado com a glicose. A glicose fervida em solução de molibdato de amônio torna a solução azul. Uma solução com índigo carmim e carbonato de sódio descolora quando fervida com glicose.
Determinação quantitativa instrumental
Refratometria e polarimetria
Em soluções concentradas de glicose com uma pequena quantidade de outros carboidratos, sua concentração pode ser determinada com um polarímetro . No caso de misturas de açúcar, a concentração pode ser determinada com um refratômetro , por exemplo, ao determinar Oechsle no decurso da produção de vinho .
Método fotométrico-enzimático em solução
A enzima glicose oxidase (GOx) converte a glicose em ácido glucônico e peróxido de hidrogênio usando oxigênio . Outra enzima, a peroxidase, catalisa uma reação cromogênica (reação de Trinder) do fenol com 4-aminoantipirina para formar um corante roxo.
Método fotométrico de tira de teste
O método da tira de teste usa a conversão enzimática acima mencionada de glicose em ácido glucônico com a formação de peróxido de hidrogênio. Os reagentes são imobilizados em uma matriz polimérica, a chamada tira teste, que adquire uma cor mais ou menos forte. Isso pode ser lido refletometricamente com o auxílio de um fotômetro portátil baseado em LED a 510 nm. Isso permite o teste de glicose no sangue de rotina por leigos. Além da reação do fenol com 4-aminoantipirina, novas reações cromogênicas têm sido desenvolvidas, as quais permitem fotometria em comprimentos de onda mais elevados (550 nm, 750 nm).
Sensores amperométricos de glicose
A eletroanálise da glicose também se baseia na conversão enzimática mencionada acima. O peróxido de hidrogênio produzido pode ser quantificado amperometricamente por oxidação anódica a um potencial de 600 mV. O GOx é imobilizado na superfície do eletrodo ou em uma membrana disposta próxima ao eletrodo. Além dos metais preciosos clássicos, como platina ou ouro, os eletrodos de nanotubos de carbono têm sido usados cada vez com mais frequência como eletrodos. B. foram dopados com boro. Os nanofios de Cu-CuO também são usados como eletrodos amperométricos sem enzimas. Um limite de detecção de 50 µmol / L foi assim alcançado. Um método particularmente promissor é a chamada "fiação enzimática". O elétron que flui durante a oxidação é desviado diretamente da enzima para o eletrodo por meio de um fio molecular.
Outros métodos sensoriais
Existem vários outros sensores químicos para glicose. Tendo em vista a importância da análise de glicose nas biociências, inúmeras sondas ópticas para sacarídeos com base no uso de ácidos borônicos também foram desenvolvidas e são particularmente adequadas para aplicações sensoriais intracelulares, onde outros métodos (ópticos) não existem. ou apenas em uma extensão limitada pode ser usado. Além dos derivados de ácido borônico orgânico, que muitas vezes se ligam altamente especificamente aos grupos 1,2-diol do açúcar, existem outros conceitos de sonda classificados de acordo com mecanismos funcionais que usam proteínas de ligação de glicose seletivas (por exemplo, Concanavalina A) como receptores . Além disso, foram desenvolvidos métodos que medem a concentração de glicose indiretamente por meio da concentração de produtos metabolizados, e. B. o consumo de oxigênio com a ajuda de sensores ópticos fluorescentes. Finalmente, existem conceitos baseados em enzimas que usam a absorvância intrínseca ou fluorescência de enzimas (marcadas com fluorescência) como transportadores de informação.
Iodometria de cobre
A glicose pode ser produzida pelo cobre - a iodometria pode ser quantificada.
Processo Cromatográfico
Especialmente para a análise de misturas complexas contendo glicose, como. B. no mel , métodos cromatográficos como cromatografia líquida de alta performance e cromatografia gasosa , freqüentemente usados em conjunto com espectrometria de massa, são usados hoje. Levando em consideração as taxas de isótopos , essa análise também pode detectar com segurança a adulteração do mel causada pela adição de açúcar. As derivatizações usando reagentes de sililação provaram ser vantajosas . Desta forma, as proporções de di- e trissacarídeos também podem ser quantificadas.
Análise in vivo
A captação de glicose nas células dos organismos é examinada com 2-desoxi- D- glicose ou fluorodesoxiglicose . ( 18 F) -Fluorodeoxiglicose é usada em oncologia e neurologia como um marcador na tomografia por emissão de pósitrons , onde é de longe a ferramenta de diagnóstico mais amplamente usada.
literatura
- Jochen Lehmann: Carboidratos. Química e biologia. 2., retrabalho. e exp. Edição. Thieme, Stuttgart / New York 1996, ISBN 3-13-532902-X .
- Hans Vogel: tabelas de açúcares e seus derivados. Springer-Verlag, Berlin 2013, ISBN 978-3-642-47764-5 .
- Günther Wolff: O metabolismo do açúcar - um estudo biográfico. In: Médico mensal . Volume 12, 1958, pp. 766-774 e 838-846.
Links da web
Evidência individual
- ↑ Entrada sobre GLUCOSE no banco de dados CosIng da Comissão da UE, acessado em 16 de fevereiro de 2020.
- ↑ a b c d Entrada para CAS no. 50-99-7 no banco de dados de substâncias GESTIS do IFA , acessado em 18 de setembro de 2014. (JavaScript necessário)
- ↑ Alfred Töpel: Química e Física do Leite: Matéria Natural - Matéria-Prima - Alimentos . Behr's Verlag DE, 2004, ISBN 3-89947-131-8 , p. 101 ( visualização limitada na pesquisa de livros do Google).
- ↑ David R. Lide (Ed.): CRC Handbook of Chemistry and Physics . 90ª edição. (Versão na Internet: 2010), CRC Press / Taylor e Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-268.
- ↑ a b c Entrada em d-glicose. In: Römpp Online . Georg Thieme Verlag, acessado em 31 de maio de 2013.
- ↑ Folha de dados de glicose (PDF) de Carl Roth , acessada em 24 de agosto de 2010.
- ↑ Thénard, Gay-Lussac, Biot, Dumas: Rapport sur un mémoire de M. Péligiot, intitulé: Recherches sur la nature et les propriétés chimiques des sucres . In: Comptes rendus , 1838, Volume 7, pp. 106-113.
- ↑ Abraham J. Domb, Joseph Kost, David Wiseman: Handbook of Biodegradable Polymers . CRC Press, 1998. ISBN 978-1-4200-4936-7 . P. 275.
- ↑ Kenji Kamide: Celulose e derivados de celulose . Elsevier, 2005, ISBN 978-0-08-045444-3 , p. 1.
- ^ Lista modelo do WHO de medicamentos essenciais. (PDF) (Não está mais disponível online.) In: World Health Organization. Outubro de 2013, arquivado do original em 23 de abril de 2014 ; acessado em 22 de abril de 2014 .
- ^ A b Benjamin Caballero, Paul Finglas, Fidel Toldrá: Enciclopédia do alimento e da saúde . Academic Press (2016). ISBN 978-0-12-384953-3 , Volume 3, pp. 239, 608.
- ↑ Marggraf: Experiências chimiques faites dans le dessein de tirer un verdadeiro sucre de diversos plantes, qui croissent dans nos contrées. 'Experimentos químicos com a intenção de extrair açúcar de verdade de várias plantas que crescem em nossas terras'. In: Histoire de l'académie des sciences et belles-lettres de Berlin (1747), p. 90: Les raisins secs, etant humectés d'une petite quantité d'eau, de maniere qu'ils mollissent, peuvent alors etre pilés , & le suc qu'on en exprime, etant depuré & épaissi, fournira une espece de Sucre. 'Passas, umedecidas com um pouco de água para amolecer, podem ser espremidas, e o suco espremido, limpo e engrossado, dá uma espécie de açúcar.'
- ↑ Aaron J. Ihde: O Desenvolvimento da Química Moderna. Harper and Row, Nova York 1964.
- ↑ a b John F. Robyt: Essentials of Carbohydrate Chemistry. (= Springer Advanced Texts in Chemistry ) 1998, ISBN 0-387-94951-8 .
- ^ Tentative Rules for Carbohydrate Nomenclature Journal of Biological Chemistry No. 247, página 613, 1972.
- ↑ John F. Robyt: Essentials of Carbohydrate Chemistry. Springer Science & Business Media, 2012, ISBN 978-1-4612-1622-3 . P. 7.
- ↑ MA Rosanoff: Sobre a classificação de Fischer de estereoisômeros. In: Journal of the American Chemical Society . 28, 1906, p. 114, doi: 10.1021 / ja01967a014 .
- ^ Emil Fischer - Biográfico. In: nobelprize.org. 15 de julho de 1919, acessado em 4 de junho de 2018 .
- ↑ Bert Fraser-Reid: glicose de van 't Hoff . In: Chem. Eng. News , 1999, Volume 77, Issue 39, página 8; doi: 10.1021 / cen-v077n039.p008 .
- ^ IUPAC: Nomenclature of Carbohydrates (Recomendações 1996) .
- ^ Otto Meyerhof - fatos. In: nobelprize.org. 15 de julho de 2018, acessado em 15 de julho de 2018 .
- ^ Hans von Euler-Chelpin - fatos. In: nobelprize.org. Recuperado em 3 de setembro de 2018 .
- ↑ Arthur Harden - Fatos. In: nobelprize.org. 17 de junho de 1940, acessado em 3 de setembro de 2018 .
- ↑ Bernardo Houssay - Fatos. In: nobelprize.org. 21 de setembro de 1971, acessado em 15 de julho de 2018 .
- ^ Carl Cori - fatos. In: nobelprize.org. 20 de outubro de 1984, acessado em 15 de julho de 2018 .
- ^ Gerty Cori - fatos. In: nobelprize.org. 26 de outubro de 1957, acessado em 15 de julho de 2018 .
- ↑ Luis Leloir - Fatos. In: nobelprize.org. 15 de julho de 2018, acessado em 15 de julho de 2018 .
- ↑ Fred W. Schenck: Glucose and Glucose-Containing Syrups . In: Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim, 2006. doi : 10.1002 / 14356007.a12_457.pub2 .
- ↑ Patrick F. Fox: Advanced Dairy Chemistry Volume 3: Lactose, water, sais and vitaminas , Springer, 1992. Volume 3, ISBN 978-0-412-63020-0 . P. 316.
- ^ Benjamin Caballero, Paul Finglas, Fidel Toldrá: Enciclopédia de comida e saúde . Academic Press (2016). ISBN 978-0-12-384953-3 , Volume 1, página 76.
- ↑ HF Bunn, PJ Higgins: Reação de monossacarídeos com proteínas: possível significado evolutivo . In: Science . 213, No. 4504, 1981, pp. 222-224. doi : 10.1126 / science.12192669 .
- ↑ Jeremy M. Berg: Stryer Biochemistry. Springer-Verlag, 2017, ISBN 978-3-662-54620-8 , página 531.
- ^ Reginald H. Garrett: Bioquímica. Cengage Learning, 2012, ISBN 978-1-133-10629-6 . Pp. 194, 199.
- ^ Donald Voet, Judith G. Voet: Bioquímica, 4a edição. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1 . P. 363.
- ^ Albert L. Lehninger, Biochemistry, 6th printing , Worth Publishers Inc. 1972, ISBN 0-87901-009-6 , página 228.
- ^ A b c Peter C. Heinrich: Löffler / Petrides Bioquímica e Pathobiochemistry. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , p. 27.
- ↑ Eusebio Juaristi, Gabriel Cuevas: The Anomeric Effect CRC Press, 1995. ISBN 0-8493-8941-0 . Pp. 9-10.
- ↑ a b Manfred Hesse, Herbert Meier, Bernd Zeeh, Stefan Bienz, Laurent Bigler, Thomas Fox: métodos espectroscópicos em química orgânica . 8., revisado. Edição. Georg Thieme, 2011, ISBN 978-3-13-160038-7 , p. 34 .
- ^ Os bancos de dados da composição do alimento mostram a lista dos alimentos. In: ndb.nal.usda.gov. Recuperado em 25 de agosto de 2018 .
- ^ Açúcar . ( 18 de julho, 2011 memento na Internet Archive ) Oregon State University ; acessado em 28 de junho de 2018.
- ↑ a b c d e f g h i P J Fellows: Food Processing Technology. Woodhead Publishing, 2016, ISBN 978-0-08-100523-1 , página 197.
- ↑ a b Thomas Becker, Dietmar Breithaupt, Horst Werner Doelle, Armin Fiechter, Günther Schlegel, Sakayu Shimizu, Hideaki Yamada: Biotechnology . In: Enciclopédia de Química Industrial de Ullmann . 7ª edição. Wiley-VCH, 2011, ISBN 978-3-527-32943-4 , Volume 6, página 48.
- ↑ Açúcar de amido . In: Merck's Lexicon of Goods . 3ª ed. 1884 ff., P. 457 f.
- ^ A b Alan Davidson: O companheiro de Oxford ao alimento. OUP Oxford, 2014, ISBN 978-0-19-104072-6 , página 527.
- ↑ a b c The Amylase Research Society of Japan: Handbook of Amylases and Related Enzymes. Elsevier, 2014, ISBN 978-1-4832-9939-6 , p. 195.
- ^ GB Madsen, BE Norman, S. Slott: A New, Heat Stable Bacterial Amylase e seu uso na liquefação de alta temperatura . In: Starch (1973), Volume 25, Edição 9, doi: 10.1002 / star.19730250906 . Pp. 304-308.
- ^ BE Norman: Uma nova enzima de desramificação para aplicação na indústria de xarope de glicose. In: Amido - força , 34, 1982, página 340, doi: 10.1002 / estrela.19820341005 .
- ↑ James N. BeMiller, Roy L. Whistler: Starch: Chemistry and Technology (= Food Science and Technology), 3rd. Edition, Academic Press, New York 2009, ISBN 0-08-092655-X .
- ↑ Xarope de milho com alto teor de frutose: perguntas e respostas. (Não está mais disponível online.) US Food and Drug Administration, 5 de novembro de 2014, arquivado a partir do original em 25 de janeiro de 2018 ; acessado em 18 de dezembro de 2017 .
- ↑ Kevin Pang: Coca mexicana um sucesso nos Estados Unidos ( lembrança de 29 de junho de 2011 no Internet Archive ) In: Seattle Times de 29 de outubro de 2004.
- ↑ Steve T. Beckett: Fabricação e uso de chocolate industrial da Beckett. John Wiley & Sons, 2017, ISBN 978-1-118-78014-5 , p. 82.
- ^ Hans-Dieter Belitz , Werner Grosch , Peter Schieberle : Química alimentar . Springer, Berlin 2009. ISBN 978-3-540-69935-4 . Pp. 270-289.
- ^ Nathan Myhrvold , Chris Young, Maxime Bilet: Cozinha modernista: A arte e a ciência de cozinhar . The Cooking Lab 2011. ISBN 978-0-9827610-0-7 . Volume 3, pp. 89ss.
- ↑ James A. Kent: Manual de Química Industrial de Riegel. Springer Science & Business Media, 2013, ISBN 978-1-4757-6431-4 , p. 938.
- ↑ Ashok Pandey: Biorrefinarias Industriais e Biotecnologia Branca. Elsevier, 2015, ISBN 978-0-444-63464-1 , p. 488.
- ^ A b c Peter C. Heinrich: Löffler / Petrides Bioquímica e Pathobiochemistry. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , página 195.
- ↑ a b c d e U. Satyanarayana: Bioquímica. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7 . P. 674.
- ↑ DH Wasserman: Quatro gramas de glicose. In: American Journal of Physiology - Endocrinology and Metabolism. Volume 296, número 1, janeiro de 2009, pp. E11-E21, doi: 10.1152 / ajpendo.90563.2008 , PMID 18840763 , PMC 2636990 (texto completo livre).
- ↑ a b c d e f g Peter C. Heinrich: Löffler / Petrides Bioquímica e Patobioquímica. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pp. 199, 200.
- ^ A b Peter C. Heinrich: Bioquímica e Pathobiochemistry de Löffler / Petrides. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , p. 214.
- ↑ Essentials of Glycobiology , Ajit Varki (ed.), 2. Edition, Cold Spring Harbor Laboratories Press ,, ISBN 978-0-87969-770-9 . Arquivado do original em 6 de dezembro de 2016.
- ↑ Peter C. Heinrich: Löffler / Petrides Bioquímica e Patobioquímica . Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , p. 404.
- ↑ Resultado da pesquisa UniProt .
- ↑ Resultado da pesquisa UniProt .
- ↑ Harold A. Harper: Medical Biochemistry. Springer-Verlag, 2013, ISBN 978-3-662-22150-1 , p. 641.
- ↑ AM Navale, AN Paranjape: Transportadores de glicose: papéis fisiológicos e patológicos. In: Revisões Biofísicas . Volume 8, número 1, março de 2016, pp. 5-9, doi: 10.1007 / s12551-015-0186-2 , PMID 28510148 , PMC 5425736 (texto completo gratuito).
- ↑ B. Thorens: GLUT2, detecção de glicose e homeostase da glicose. In: Diabetologia . Volume 58, Número 2, fevereiro de 2015, pp. 221-232, doi: 10.1007 / s00125-014-3451-1 , PMID 25421524 .
- ^ RC Bonadonna, S. Del Prato, E. Bonora, MP Saccomani, G. Gulli, A. Natali, S. Frascerra, N. Pecori, E. Ferrannini, D. Bier, C. Cobelli, RA DeFronzo: Roles of glucose transporte e fosforilação de glicose na resistência à insulina muscular de NIDDM. In: Diabetes. Volume 45, Número 7, julho de 1996, pp. 915-925, PMID 8666143 .
- ↑ S. Huang, MP Tcheco: O transportador de glicose GLUT4. In: Cell Metabolism . Volume 5, Número 4, abril de 2007, pp. 237-252, doi: 10.1016 / j.cmet.2007.03.006 , PMID 17403369 .
- ↑ R. Govers: regulação celular da captação de glicose pelo transportador de glicose GLUT4. In: Advances in Clinical Chemistry . Volume 66, 2014, pp. 173-240, PMID 25344989 .
- ↑ C. Ghezzi, DD Loo, EM Wright: Fisiologia do tratamento da glicose renal via SGLT1, SGLT2 e GLUT2. In: Diabetologia . [Publicação eletrônica antes de ir para a impressão] Agosto de 2018, doi: 10.1007 / s00125-018-4656-5 , PMID 30132032 .
- ↑ SB Poulsen, RA Fenton, T. Rieg: Sodium-glucose cotransport. In: Opinião atual em nefrologia e hipertensão. Volume 24, número 5, setembro de 2015, pp. 463-469, doi: 10.1097 / MNH.0000000000000152 , PMID 26125647 , PMC 5364028 (texto completo gratuito).
- ^ Donald Voet, Judith G. Voet: Bioquímica, 4a edição . John Wiley & Sons, 2010, ISBN 978-0-470-57095-1 . P. 359.
- ^ A b Donald Voet, Judith G. Voet: Bioquímica, 4a edição. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1 . P. 59.
- ↑ a b Leszek Szablewski: homeostase da glicose e resistência à insulina. Bentham Science Publishers, 2011, ISBN 978-1-60805-189-2 , página 46.
- ↑ AM Smith, SC Zeeman, SM Smith: Degradação do amido. In: Revisão Anual de Biologia Vegetal . Volume 56, 2005, pp. 73-98, doi: 10.1146 / annurev.arplant.56.032604.144257 , PMID 15862090 .
- ↑ MM-Adeva qualquer imposto, N. Pérez-Felpete, C. Fernandez-Fernandez, C. Donapetry-García, C. Pazos-García: metabolismo da glicose hepática em humanos. In: Relatórios de biociências . Volume 36, número 6, 12 2016, p. E00416, doi: 10.1042 / BSR20160385 , PMID 27707936 , PMC 5293555 (texto completo livre).
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn e Carsten Biele (tradutor): Biochemie . Estudos de Pearson; 4ª edição atualizada de 2008; ISBN 978-3-8273-7312-0 ; Pp. 490-496.
- ^ A b Brian K. Salão: Evolução de Strickberger. Jones & Bartlett Publishers, 2013, ISBN 978-1-4496-1484-3 , p. 164
- ^ Reginald H. Garrett: Bioquímica. Cengage Learning, 2012, ISBN 978-1-133-10629-6 , p. 551.
- ↑ JG Jones: Glicose hepática e metabolismo lipídico. In: Diabetologia . Volume 59, número 6, 06 2016, pp. 1098-1103, doi: 10.1007 / s00125-016-3940-5 , PMID 27048250 .
- ↑ N. Entner, M. Doudoroff: Glucose and gluconic acid oxidation of Pseudomonas saccharophila . In: J Biol Chem . , 1952, 196 (2), pp. 853-862 (Inglês); PMID 12981024 ; jbc.org (PDF).
- ^ A. Annibaldi, C. Widmann: Metabolismo da glicose em células cancerosas. In: Opinião Atual em Nutrição Clínica e Cuidados Metabólicos . Volume 13, Número 4, julho de 2010, pp. 466-470, doi: 10.1097 / MCO.0b013e32833a5577 , PMID 20473153 .
- ↑ XD Xu, SX Shao, HP Jiang, YW Cao, YH Wang, XC Yang, YL Wang, XS Wang, HT Niu: Efeito Warburg ou efeito Warburg reverso? Uma revisão do metabolismo do câncer. In: Oncology Research and Treatment . Volume 38, número 3, 2015, pp. 117-122, doi: 10.1159 / 000375435 , PMID 25792083 .
- ↑ L. Szablewski: Expressão de transportadores de glicose em cânceres. Em: Biochimica et Biophysica Acta . Volume 1835, Número 2, abril de 2013, pp. 164-169, doi: 10.1016 / j.bbcan.2012.12.004 , PMID 23266512 .
- ↑ K. Adekola, ST Rosen, M. Shanmugam: transportadores de glicose no metabolismo do câncer. In: Opinião Atual em Oncologia . Volume 24, Número 6, novembro de 2012, pp. 650-654, doi: 10.1097 / CCO.0b013e328356da72 , PMID 22913968 .
- ^ RH De Deken: O efeito Crabtree: um sistema regulatório em leveduras. In: Journal of General Microbiology . Volume 44, Número 2, agosto de 1966, pp. 149-156, doi: 10.1099 / 00221287-44-2-149 , PMID 5969497 .
- ↑ E. de Old Riis, F. Cartenì, P. Parascandola, J. Serpa, S. Mazzoleni: Revisitando o efeito Crabtree / Warburg em uma perspectiva dinâmica: uma vantagem de aptidão contra a morte celular induzida por açúcar. In: Cell Cycle . Volume 17, número 6, 2018, pp. 688-701, doi: 10.1080 / 15384101.2018.1442622 , PMID 29509056 , PMC 5969562 (texto completo gratuito).
- ↑ Química de Georg Schwedt Zuckersüße. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8 , página 100.
- ↑ Schmidt, Lang: Physiologie des Menschen, 30ª edição. Springer Verlag, 2007, p. 907.
- ↑ T. Dandekar, S. Schuster, B. Snel, M. Huynen, P. Bork: alinhamento da via: aplicação à análise comparativa de enzimas glicolíticas. In: Biochem. J. 343 Pt 1, 1999, pp. 115-124 ( PMID 10493919 ; PMC 1220531 (texto completo livre)).
- ↑ a b c L. L. Koekkoek, JD Mul, SE la Fleur: Sensor de glicose no sistema de recompensa. In: Frontiers in Neuroscience . Volume 11, 2017, p. 716, doi: 10.3389 / fnins.2017.00716 , PMID 29311793 , PMC 5742113 (texto completo livre).
- ↑ a b R. M. Tucker, SY Tan: Os adoçantes não nutritivos influenciam a homeostase aguda da glicose em humanos? Uma revisão sistemática. In: Physiology & Behavior . Volume 182, dezembro de 2017, pp. 17-26, doi: 10.1016 / j.physbeh.2017.09.016 , PMID 28939430 .
- ^ SE La Fleur, E. Aviador, A. Kalsbeek: Neurociência da homeostase da glicose. In: Handbook of Clinical Neurology . Volume 126, 2014, pp. 341-351, doi: 10.1016 / B978-0-444-53480-4.00026-6 , PMID 25410233 .
- ^ PH Bisschop, E. Aviador, A. Kalsbeek: Regulação autonômica da produção de glicose hepatic. In: Comprehensive Physiology . Volume 5, Número 1, janeiro de 2015, pp. 147-165, doi: 10.1002 / cphy.c140009 , PMID 25589267 .
- ^ WA Scherbaum, BM Lobnig, em: Hans-Peter Wolff, Thomas R. Weihrauch: Terapia interna 2006, 2007. 16ª edição. Elsevier, Munich 2006, ISBN 3-437-23182-0 , pp. 927, 985.
- ↑ Harold A. Harper: Medical Biochemistry. Springer-Verlag, 2013, ISBN 978-3-662-22150-1 , página 294.
- ↑ a b c Donard Dwyer: Metabolismo da glicose no cérebro. Academic Press, 2002, ISBN 978-0-12-366852-3 , página XIII.
- ↑ SH Fairclough, K. Houston: Uma medida metabólica do esforço mental. In: Biological Psychology . Volume 66, Número 2, abril de 2004, pp. 177-190, doi: 10.1016 / j.biopsycho.2003.10.001 , PMID 15041139 .
- ↑ MT Gailliot, RF Baumeister: A fisiologia da força de vontade: ligando a glicose no sangue ao autocontrole. In: Revisão de personalidade e psicologia social: um jornal oficial da Society for Personality and Social Psychology, Inc. Volume 11, Número 4, novembro de 2007, pp. 303-327, doi: 10.1177 / 1088868307303030 , PMID 18453466 .
- ^ A b Richard A. Harvey, Denise R. Ferrier: Bioquímica. 5ª Edição, Lippincott Williams & Wilkins, 2011, ISBN 978-1-60831-412-6 , página 366.
- ↑ a b U. Satyanarayana: Bioquímica. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7 , p. 508.
- ↑ SH Holt, JC Miller, P. Petocz: Um índice de insulina dos alimentos: a demanda de insulina gerada por porções de 1000 kJ de alimentos comuns. In: The American Journal of Clinical Nutrition . Volume 66, edição 5, novembro de 1997, pp. 1264-1276, doi: 10.1093 / ajcn / 66.5.1264 , PMID 9356547 .
- ^ P. Concannon, SS Rich, GT Nepom: Genética do diabetes tipo 1A. In: The New England Journal of Medicine . Volume 360, Número 16, abril de 2009, pp. 1646-1654, doi: 10.1056 / NEJMra0808284 , PMID 19369670 .
- ↑ R. Goyal, I. Jialal: Glucose Intolerance. In: StatPearls [Internet]. Treasure Island (FL), 2018. PMID 29763085 .
- ↑ R. Buresh: Exercício e controle de glicose. In: The Journal of Sports Medicine and Physical Fitness . Volume 54, Número 4, agosto de 2014, pp. 373-382, PMID 25034542 .
- ↑ H. Yki-Järvinen: doença hepática gordurosa não alcoólica como causa e consequência da síndrome metabólica. In: The Lancet . Diabetes e endocrinologia. Volume 2, número 11, novembro de 2014, pp. 901-910, doi: 10.1016 / S2213-8587 (14) 70032-4 , PMID 24731669 .
- ↑ H. Fehling: Determinação quantitativa de açúcar na urina. In: Archives for Physiological Medicine (1848), Volume 7, pp. 64-73.
- ↑ B. Tollens: Sobre a solução de prata amoniacal como reagente para aldeído . In: Relatórios da Sociedade Química Alemã . 15, 1882, pp. 1635-1639.
- ↑ C. Barfoed: Sobre a detecção de açúcar de uva além de dextrina e corpos relacionados . In: Journal for Analytical Chemistry . 12, No. 1, 1873, página 27. doi : 10.1007 / BF01462957 .
- ^ Emil Nylander: Sobre a solução alcalina de bismuto como um reagente para glicose na urina , revista para química fisiológica . Volume 8, Issue 3, 1884, pp. 175-185 ( resumo ).
- ↑ a b c d e f g h i j k Georg Schwedt: Química Zuckersweet. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8 , página 102.
- ↑ P. Trinder: Determinação de glicose no sangue usando glicose oxidase com um aceitador de oxigênio alternativo. In: Annals of Clinical Biochemistry . 6, 1969, pp. 24-27; doi: 10.1177 / 000456326900600108 .
- ↑ M. Mizoguchi, M. Ishiyama, M. Shiga, K. Sasamoto: Reagente cromogênico solúvel em água para detecção colorimétrica de peróxido de hidrogênio - uma alternativa para 4-aminoantipirina trabalhando em um comprimento de onda longo. In: Comunicações analíticas . 35, 1998, pp. 71-73; doi: 10.1039 / A709038B .
- ^ J. Wang: Biossensores eletroquímicos da glicose. In: Chem. Rev. 108, 2008, pp. 814-825; PMID 18154363 .
- ↑ X. Chen, J. Chen, Ch. Deng, Ch. Xiao, Y. Yang, Z. Nie, S. Yao: Biossensor de glicose amperométrico baseado em eletrodo modificado de nanotubos de carbono dopados com boro. In: Talanta . 76, 2008, pp. 763-767; doi: 10.1016 / j.talanta.2008.04.023 ; PMID 18656655 .
- ↑ G. Wang, Y. Wei, W. Zhang, X. Zhang, B. Fang, L. Wang: Enzyme-free amperometric sensing of glucose using Cu-CuO nanowire composites. In: Microchimica Acta . 168, 2010, pp. 87-92; doi: 10.1007 / s00604-009-0260-1 .
- ^ TJ Ohara, R. Rajagopaian, A. Heller: Eletrodos de enzima "com fio" para determinação amperométrica de glicose ou lactato na presença de substâncias interferentes. In: Anal. Chem. , 66, 1994, pp. 2451-2457; doi: 10.1021 / ac00087a008 ; PMID 8092486 .
- ↑ a b c S. M. Borisov, OS Wolfbeis: Optical Biosensors. In: Chem. Rev. 108, 2008, pp. 423-461; doi: 10.1021 / cr068105t ; PMID 18229952 .
- ↑ S. Ferri, K. Kojima, K. Sode: Revisão das glicose oxidases e glicose desidrogenases: uma visão panorâmica das enzimas sensíveis à glicose. In: Journal of Diabetes Science and Technology . Volume 5, número 5, setembro de 2011, pp. 1068-1076, doi: 10.1177 / 193229681100500507 , PMID 22027299 , PMC 3208862 (texto completo gratuito).
- ↑ HS Mader, OS Wolfbeis: Sondas baseadas em ácido borônico para microdeterminação de sacarídeos e biomoléculas glicosiladas. In: Microchimica Acta , 162, 2008, pp. 1-34; doi: 10.1007 / s00604-008-0947-8 .
- ↑ OS Wolfbeis, I. Oehme, N. Papkovskaya, I. Klimant: Biossensores de glicose baseados em Sol-Gel que empregam transdutores ópticos de oxigênio e um método para compensação de fundo de oxigênio variável. In: Biossensors & Bioelectronics . 15, 2000, pp. 69-76; doi: 10.1016 / S0956-5663 (99) 00073-1 .
- ↑ a b A. L. Galant, RC Kaufman, JD Wilson: Glucose: Detection and analysis. In: Food Chemistry . Volume 188, dezembro de 2015, pp. 149-160, doi: 10.1016 / j.foodchem.2015.04.071 , PMID 26041177 .
- ↑ ML Sanz, J. Sanz, I. Martínez-Castro: Método cromatográfico gasoso-espectrométrico de massa para a determinação qualitativa e quantitativa de dissacarídeos e trissacarídeos no mel. Em: Journal of Chromatography A 1059 (1-2), 2004, pp 143-148; PMID 15628134 .
- ↑ hummel@mpimp-golm.mpg.de: GMD - Glicose (1MEOX) (5TMS) BP - InChI = 1S / C22H55NO6Si5 / c1-24-23-17-19 (26-31 (5,6) 7) 21 (28- 33 (11,12) 13) 22 (29-34 (14,15) 16) 20 (27-32 (8,9) 10) 18-25-30 (2,3) 4 / h17,19- 22H. Em: gmd.mpimp-golm.mpg.de. 19 de julho de 2007. Recuperado em 4 de junho de 2018 .
- ^ AI Cabañero, JL Recio, M. Rupérez: Cromatografia líquida acoplada a espectrometria de massa de razão de isótopos: uma nova perspectiva na detecção de adulteração de mel. In: J Agric Food Chem . 54 (26), 27 de dezembro de 2006, pp. 9719-9727; PMID 17177492 .
- ↑ M. Becker, F. Ler, T. Rosenau, A. Potthast: Ethoximation-sillation approach fiebnor mono- e dissacarídeo análise e caracterização de seus parâmetros de identificação por GC / MS. In: Talanta . 115, 2013, pp. 642-651; PMID 24054643 .
- ^ Sociedade de Químicos Alemães: Anexos ao documento de posição da Seção de Química Nuclear ( Memento de 31 de março de 2010 no Arquivo da Internet ), fevereiro de 2000.
- ↑ Simone Maschauer, Olaf Prante: Sweetening Pharmaceutical Radiochemistry by 18 F-Fluoroglycosylation: A Short Review . In: BioMed Research International , Volume 2014, Artigo ID 214748; doi: 10.1155 / 2014/214748 ; PMID 24991541 ; PMC 4058687 (texto completo gratuito).