Eritropoietina
| Eritropoietina | ||
|---|---|---|
| ||
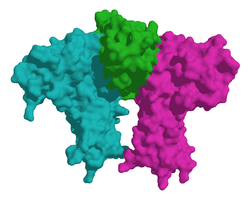
| Modelo de superfície de eritropoietina (centro) em complexo com seu receptor, de acordo com PDB 1EER | ||
| Propriedades da proteína humana | ||
| Estrutura primária de massa / comprimento | 165 aminoácidos ; 34 kDa | |
| Estrutura secundária para quaternária | Glicoproteína | |
| Precursor | Proteína PrePro-EPO | |
| Identificador | ||
| Nomes de genes | EPO ; EP; MGC138142 | |
| IDs externos | ||
| Informação sobre drogas | ||
| Código ATC |
B03 XA01 B03 XA02 |
|
| DrugBank | DB00016 | |
| Aula de drogas | hormônio | |
| Ocorrência | ||
| Família de homologia | Eritropoietina-2 | |
| Táxon pai | Euteleostomi | |
| Ortólogo | ||
| humano | Rato doméstico | |
| Entrez | 2056 | 13856 |
| Conjunto | ENSG00000130427 | ENSMUSG00000029711 |
| UniProt | P01588 | P07321 |
| Refseq (mRNA) | NM_000799 | NM_001312875 |
| Refseq (proteína) | NP_000790 | NP_001299804 |
| Locus gênico | Chr 7: 100,72 - 100,72 Mb | Chr 5: 137,48 - 137,49 Mb |
| Pesquisa PubMed | 2056 |
13856
|
Eritropoietina [ eˌʁyːtʁoˌpoːetiːn ] (a partir de antigos gregos ἐρυθρός erythros , vermelho 'e ποιεῖν poiein , faça'; Sinônimos : eritropoietina , epoetina , EPO ou Epo , historicamente também hematopoietina , fator eritropoiética (rim) , fator Erythropoiesestimulierender (FSE) ) é uma glicoproteína - Hormona importante como fator de crescimento para a formação de glóbulos vermelhos durante a formação do sangue , especialmente após grandes perdas sanguíneas e quando há maior necessidade de glóbulos vermelhos ao subir a grandes altitudes com redução da pressão parcial de oxigênio . A eritropoietina é um dos chamados " Agentes Estimulantes da Eritropoiese " (forma abreviada: ESA). Como agente terapêutico, a eritropoietina produzida biotecnologicamente é usada principalmente no tratamento da anemia em pacientes em diálise nos quais a formação de sangue é prejudicada como resultado de insuficiência renal e após ciclos de quimioterapia agressivos. A eritropoetina tornou-se bem conhecida por meio de numerosos casos de doping no esporte profissional .
biossíntese
Quando o conteúdo de oxigênio do sangue é reduzido, a biossíntese de EPO é desencadeada por fatores de transcrição . Isso ocorre principalmente nos rins . O hormônio produzido atinge seu local de ação através da corrente sanguínea.
Em humanos, cerca de 90% da EPO é produzida nos rins por fibroblastos no córtex renal que estão localizados ao redor dos túbulos renais . O suprimento de oxigênio para o tecido renal atua como um regulador da produção de EPO. Cerca de 10% formam-se nas hepatócitos do fígado . Além disso, foi detectada uma atividade de síntese fisiologicamente insignificante no cérebro , no útero , nos testículos , no baço e também nas células do folículo capilar .
O gene EPO em humanos está localizado no cromossomo 7 (posição 7q21-7q22). A síntese é estimulada por uma redução da saturação de oxigênio ( hipóxia ) do sangue. Isso leva ao deslocamento da subunidade α do “ fator induzido por hipóxia ” (HIF para abreviar) do citoplasma para o núcleo das células que expressam EPO . Nesse local, o HIF-α se liga à subunidade β correspondente (HIF-β), que cria o heterodímero HIF-1 acabado . Este, por sua vez, se liga à "proteína de ligação ao elemento de resposta do cAMP" (abreviação CREB ) e a outro fator de transcrição (p300). O complexo proteico resultante, que agora consiste em três elementos, inicia a transcrição no mRNA associado ao se ligar à extremidade 3 'do gene EPO . Isso é para os ribossomos na proteína eritropoietina traduzida .
Função biológica

setas vermelhas: eritropoiese ;
TGF = fator transformador de crescimento ;
MIP = Proteína Inflamatória de Macrófagos;
IL = interleucina ;
G-CSF = Fator Estimulador de Colônias de Granulócitos ;
SCF = fator de células-tronco ;
IGF = fator de crescimento semelhante à insulina ;
FLT-3 / FLK-2 = receptor tirosina quinase ;
BFU-E = Unidade formadora de erupções eritroides;
CFU-E = Unidade Formadora de Colônia Eritróide
A eritropoietina atua em todas as partes do corpo onde o chamado receptor da EPO é formado na superfície das células. Trata-se, em particular, das células estaminais da medula óssea e também de outros tecidos , de onde emergem continuamente novas células sanguíneas. Em particular, a EPO faz com que os eritrócitos (glóbulos vermelhos) se desenvolvam a partir dessas células- tronco .
Formação de eritrócitos
Sobre a formação e desenvolvimento de glóbulos vermelhos, consulte também o artigo principal eritropoiese .
A concentração sérica do hormônio em pessoas saudáveis está entre 6 e 32 mU / mL e a meia-vida plasmática entre 2 e 13 horas. Na eritropoiese , a EPO liga-se na medula óssea ao receptor transmembranar de eritropoietina das células precursoras do tipo BFU-E ( unidade formadora de explosão eritróide ), que primeiro se diferenciam nas células precursoras CFU-E ( Unidade formadora de colônia eritróide ) mais maduras e finalmente em eritrócitos .

O receptor (EpoR) pertence à família das citocinas de receptores cujos semelhanças estruturais consistem em dois ou mais immunoglobulin- como domínios , quatro idêntica dispostas cisteína resíduos e o extracelular sequência WSXWS ( Trp - Ser - aminoácido variável - Trp - Ser ). A ligação da EPO leva a uma homodimerização do receptor, que por sua vez via Trans fosforilação a enzima Janus quinase acoplada ao receptor ativada -2. Resíduos de tirosina associados a receptores intracelulares específicos são fosforilados e servem como uma estação de acoplamento para a proteína de transdução de sinal STAT5 , que coloca várias cascatas de transdução de sinal em movimento. Um total de 94 proteínas estão envolvidas.
Cerca de 200 bilhões de eritrócitos são formados todos os dias. Além da eritropoiese real, a EPO atua como um inibidor da apoptose na diferenciação das células progenitoras e, em pequena extensão, também estimula a formação de megacariócitos . Agudas e crónicas insuficiências , como resultado de degenerativas doenças do rim de chumbo para a formação de EPO reduzida e, assim, para renal anemia .
Mais funções
O papel da EPO no organismo não se limita à formação de novos eritrócitos. Estudos de hibridização imunocitoquímica demonstraram que o EpoR pode ser encontrado em uma ampla variedade de células somáticas . Estes incluem neurônios , astrócitos , células microgliais e musculares cardíacas . As interações EPO / EpoR foram demonstradas em vários tecidos não hematopoiéticos em conexão com processos de divisão celular , quimiotaxia , angiogênese , ativação do cálcio intracelular e inibição da apoptose. Locais específicos de ligação da EPO foram detectados em células nervosas, especialmente no hipocampo , uma região do cérebro que é particularmente suscetível a danos causados por falta de oxigênio . No modelo de camundongo, foi demonstrado que a administração direcionada de EPO aumenta a atividade nervosa no hipocampo e, assim, pode-se observar uma melhora no aprendizado e no desempenho da memória nos animais, independentemente das propriedades de formação de sangue do hormônio. Um efeito protetor da EPO foi demonstrado em vários modelos animais de infarto cerebral e falta de oxigênio . Essas descobertas podem oferecer novas abordagens terapêuticas para doenças crônicas (esclerose múltipla, esquizofrenia), bem como doenças neurológicas agudas (acidente vascular cerebral) (ver indicações para terapia com EPO ).
No modelo de camundongo, pode ser demonstrado que a propriedade citoprotetora da EPO em células do músculo cardíaco é baseada na ação da enzima heme oxigenase-1 , cuja expressão é desencadeada pela EPO via cascata de transdução de sinal p38 MAPK .
Propriedades estruturais

Asn24 : N-glicosilado, tri-antenário, di-sialilado.
Asn38 : N-glicosilado, tetra-antenário, tetra-sialilado.
Asn83 : N-glicosilado, tetra-antenário, tri-sialilado.
Ser126 : O-glicosilado, mono-antenário, di-sialilado.
Filogeneticamente, a EPO pertence a uma família de citocinas que, além da EPO, também inclui somatropina , prolactina , interleucinas 2–7 e os chamados "Fatores Estimulantes de Colônias" ( G-CSF , M-CSF e GM-CSF ).
Sequência de aminoácidos de EPO ( código de uma letra )
- verde : peptídeo sinal N-terminal
- vermelho : resíduo de arginina C-terminal
|
10 20 30 40 50 60
MGVHECPAWL WLLLSLLSLP LGLPVLG APP RLICDSRVLE RYLLEAKEAE NITTGCAEHC |
|
70 80 90 100 110 120
SLNENITVPD TKVNFYAWKR MEVGQQAVEV WQGLALLSEA VLRGQALLVN SSQPWEPLQL |
|
130 140 150 160 170 180
HVDKAVSGLR SLTTLLRALG AQKEAISPPD AASAAPLRTI TADTFRKLFR VYSNFLRGKL |
|
190 KLYTGEACRT GD R |

O gene EPO (5,4 kb, 5 exões e 4 intrões ) codifica uma proteína prepro EPO com 193 resíduos de aminoácidos. No caso de modificação pós-tradução , um peptídeo sinal com 27 resíduos de aminoácidos no N- terminal e um resíduo de arginina no C- terminal é separado por uma carboxipeptidase intracelular .
Quimicamente, a EPO humana é um polipeptídeo ácido não ramificado composto por 165 aminoácidos com uma massa molecular de cerca de 34 kDa . A estrutura secundária consiste em quatro hélices α antiparalelas incluindo loops adjacentes. O conteúdo de carboidratos, que é cerca de 40% da massa molecular, consiste em uma cadeia lateral de açúcar ligada a O- glicosídica ( Ser 126) e três N- glicosídica ( Asn 24, Asn 38 e Asn 83). As cadeias laterais, por sua vez, são compostas pelos monossacarídeos manose , galactose , fucose , N- acetilglicosamina , N- acetilgalactosamina e ácido N- acetilneuramínico . As cadeias laterais N- glicosidicamente ligadas têm vários ramos, que também são conhecidos como “ antenas ”. Em contraste com a constante sequência de aminoácidos da molécula de EPO, as estruturas de açúcar são variáveis. Nesse contexto, fala-se da microheterogeneidade da molécula da EPO, que ocorre tanto na EPO natural (nativa) quanto na recombinante . Este é caracterizado por um lado por sequências variáveis de monossacarídeos nas cadeias laterais de açúcar, por outro lado, pelo número variável de ácidos N- acetilneuramínicos terminais . Estes, também conhecidos pelo nome comum de ácidos siálicos , são decisivos para a atividade biológica da glicoproteína : quanto maior o grau de sialilação, maior a atividade e a meia-vida sérica do hormônio. É digno de nota que altamente sialiladas isoformas mostrar uma menor afinidade para o receptor de EPO na in vitro experiências . Isso, por sua vez, explica por que as isoformas asiáticas, nas quais os ácidos siálicos terminais foram removidos, são exauridas diretamente no fígado pelas células parenquimatosas ( hepatócitos ) que carregam o receptor da EPO devido à alta afinidade pelo receptor e, portanto, são ineficazes. As isoformas funcionais, por outro lado, são gradualmente decompostas por outras células do corpo que carregam o receptor da EPO. Quando degradadas, as moléculas de EPO são internalizadas em lisossomas por uma endocitose mediada por receptor e quebradas ali. Em estudos posteriores com moléculas do tipo EPO sem afinidade para o receptor, pode ser demonstrado que a endocitose mediada pelo receptor da EPO contribui apenas parcialmente para a depleção da EPO da corrente sanguínea. Em vez disso, as vias de degradação através do tecido do estroma e do sistema linfático parecem ser decisivas. Parece que macrófagos e neutrófilos também estão envolvidos.
As cadeias laterais do açúcar também influenciam a estabilidade da molécula de EPO e, portanto, exercem uma função protetora. A EPO desglicosilada, que não possui cadeias laterais de açúcar, é significativamente mais sensível ao pH e à desnaturação induzida pela temperatura do que a EPO natural glicosilada.
Uma característica especial opcional da molécula de EPO é a sulfatação das cadeias laterais de açúcar N- glicosídico. A função exata da sulfatação, que pode ser detectada tanto na molécula nativa quanto na recombinante , ainda não é conhecida.
As propriedades citoprotetoras da EPO (ver capítulo Função biológica ) são evidentemente determinadas pelas sequências peptídicas da α-hélice B na molécula de EPO. Isto foi demonstrado por estudos in vitro e in vivo com péptidos de sequência homóloga sintética. Em contraste, as referidas sequências não têm propriedades eritropoiéticas.
EPO como medicamento
História da pesquisa
A história da pesquisa da eritropoietina está intimamente ligada ao conhecimento adquirido sobre a origem e função do sangue. A importância do sangue para a vitalidade humana é conhecida desde o início da história . Em muitas culturas, o sangue está no centro das cerimônias rituais. Freqüentemente, o sangue de um animal forte ou de um inimigo morto era administrado para transferir sua força e coragem para o recipiente.
A primeira transfusão de sangue bem-sucedida para o tratamento da anemia foi feita por Jean-Baptiste Denis , médico pessoal de Luís XIV, e pelo cirurgião Paul Emmerez († 1690) em 15 de junho de 1667 em Paris . Eles deram ao paciente, cujo estado melhorou significativamente após a transfusão, sangue de cordeiro. O ginecologista e obstetra inglês James Blundell (1791-1878) realizou a primeira transfusão homóloga bem-sucedida em humanos em 1825, na qual uma paciente com sangramento abundante recebeu sangue de seu marido. No entanto, os médicos responsáveis pelo tratamento permaneceram ocultos do contexto preciso para a eficácia de suas terapias. Foi somente em meados do século XIX que Felix Hoppe-Seyler, com a descoberta da hemoglobina, e Ernst Neumann, por meio de seu trabalho sobre a medula óssea como local de formação do sangue, deram os primeiros conhecimentos sobre a origem e função da sangue.
Em 1863, o médico francês Denis Jourdanet reconheceu indiretamente a conexão entre a redução da pressão parcial de oxigênio e o aumento do número de eritrócitos ao realizar exames hematócritos em pessoas que haviam permanecido por muito tempo em grandes altitudes nos Alpes . Jourdanet descobriu que o sangue de seus pacientes era mais espesso do que o de seus pacientes “normais”. Friedrich Miescher estabeleceu a conexão direta em 1893. Miescher descreveu a formação de eritrócitos como resultado de um suprimento reduzido de oxigênio para a medula óssea. Com base nisso, esforços têm sido feitos para tratar a anemia por meio de hipóxia especificamente induzida.
Em 1906, o francês Paul Carnot (1869–1957) e sua colega Catherine Deflandre levantaram a hipótese de que um fator humoral regula a formação do sangue. A hipótese deles baseava-se em experimentos em que o soro do sangue de coelhos que anteriormente se tornara anêmico por sangramento , após a injeção em coelhos saudáveis, aumentava notavelmente o número de glóbulos vermelhos nestes. Inúmeras tentativas de outros pesquisadores de reproduzir os resultados de Carnot e Deflandre falharam. Foi somente com o uso da fenil-hidrazina, um químico hemolítico para induzir a anemia, que outros pesquisadores, como em 1911 Camillo Gibelli, da Universidade de Gênova , no cenário experimental de Carnot e Deflandre , também puderam manter suas hipóteses. . Evidências adicionais para a correção da hipótese do fator humoral foram fornecidas por experimentos nos quais a formação de sangue em animais normais poderia ser aumentada pelo soro de animais mantidos em condições de hipóxia. Em particular, Georges Sandor (1906–1997) do Instituto Pasteur conseguiu alcançar um sucesso significativo na década de 1930. Os dois nefrologistas finlandeses Eva Bonsdorff (* 1918) e Eeva Jalavisto (1909-1966) finalmente chamaram este fator de eritropoietina , ou EPO , em 1948 .
O verdadeiro “descobridor” é geralmente considerado Allan Jacob Erslev , que em 1953 publicou as primeiras publicações científicas bem fundamentadas nas quais a existência da eritropoietina foi inequivocamente comprovada. No entanto, Eugene Goldwasser se tornou a figura-chave nas pesquisas futuras do EPO . Em 1954, ele e seu grupo de pesquisa da Universidade de Chicago confirmaram o trabalho de Erslev com seus próprios resultados. Goldwasser e seu colega Leon Orris Jacobson foram inicialmente capazes de provar indiretamente em 1957 que a EPO é formada nos rins, e em 1977 eles foram capazes de isolar a EPO humana da urina em uma escala de miligramas pela primeira vez . Em 1983, Fu-Kuen Lin , um funcionário da Amgen , conseguiu identificar o gene EPO humano. Em 1984, Sylvia Lee-Huang do New York University Medical Center relatou pela primeira vez sobre o sucesso da clonagem e expressão de EPO humana recombinante (rhEPO) em Escherichia coli , que também foi realizada em células de mamíferos em 1985. Isto tornou possível a produção em larga escala de EPO recombinante em quantidades adequadas.
Indicações para terapia com EPO
Dos fatores de crescimento atualmente usados clinicamente, EPO tem o maior espectro de indicações . A terapia clássica com EPO visa iniciar ou apoiar a formação de glóbulos vermelhos em pacientes com anemia renal , anemia tumoral e anemia como resultado da quimioterapia . Além disso, agora foi estabelecido que a taxa de resposta de tumores hipóxicos ao rádio ou quimioterapia pode ser aumentada aumentando a oxigenação do tumor após a aplicação de EPO.
Doenças Hematológicas
Na anemia renal, a EPO é geralmente administrada aos pacientes ao mesmo tempo que a hemodiálise . Um estudo de curto prazo norte-americano indicou que existem diferentes requisitos típicos da população para o uso de EPO. Neste estudo, os pacientes em diálise de ascendência negra africana necessitaram em média de doses de EPO 12% mais altas do que os brancos para elevar o nível de hemoglobina a uma faixa fisiológica.
Outro estudo retrospectivo descobriu que a taxa de sobrevivência de pacientes em diálise com insuficiência renal em estágio final após a administração de EPO aumenta se esses pacientes viverem em altitudes alpinas. Em muitos casos, a terapia com EPO pode ser apoiada pela administração simultânea de preparações de ferro para a formação do sangue. O patomecanismo molecular da anemia tumoral, que pode ser remediado pela adição de EPO, é baseado na utilização prejudicada do ferro . Uma vez que esses mecanismos também podem ser demonstrados em infecções crônicas (como doença de Crohn , colite ulcerosa ) ou sepse , o uso de EPO como medida de apoio à terapia foi investigado em estudos clínicos por vários anos . Formas de EPO de terapia para fadiga , síndrome mielodisplásica , anemia aplástica , osteomielofibrose e infecções por HIV também são discutidas.
A chamada picnocitose infantil , uma forma especial de poiquilocitose hereditária , é uma doença rara em recém-nascidos que se caracteriza por eritrócitos deformados e é acompanhada por anemia grave. No passado, eram necessárias transfusões frequentes de glóbulos vermelhos para tratar esta doença. Em setembro de 2008, um grupo de pesquisa italiano relatou pela primeira vez casos terapêuticos bem-sucedidos com EPO, nos quais subsequentemente as transfusões de eritrócitos puderam ser completamente dispensadas.
Abordagens experimentais para o tratamento de doenças neurológicas
Suas propriedades citoprotetoras em cultura de células e modelos animais também tornam a EPO um candidato interessante para o tratamento de doenças neurológicas agudas, como acidente vascular cerebral . Embora os modelos animais de derrame e um estudo piloto humano inicial tenham se mostrado promissores, os resultados de um grande ensaio clínico randomizado no tratamento de pacientes com derrame permaneceram preocupantes.
Com base em trabalhos experimentais e pequenos estudos clínicos, também foi postulado um papel no tratamento de doenças crônicas do sistema nervoso central. Com base em um estudo realizado em oito pacientes, especulou-se se a EPO em altas doses poderia ser terapêutica no tratamento da esclerose múltipla cronicamente progressiva . Em um estudo realizado em 12 pacientes com ataxia de Friedreich , uma redução nas concentrações de frataxina linfocítica foi observada após a administração de EPO . No modelo de camundongo, a EPO mostrou um efeito retardador no desenvolvimento da esclerose lateral amiotrófica (ALS) . No modelo do rato, a EPO evidentemente promove o crescimento axonal de fibras nervosas cortadas.
Abordagens experimentais para tratamento de doenças psiquiátricas
De acordo com um estudo piloto publicado em 2006, a EPO como agente terapêutico auxiliar no tratamento de pacientes esquizofrênicos pode causar uma ligeira melhora nas habilidades cognitivas . Os autores assumem que o efeito observado pode ser baseado nas propriedades protetoras da EPO contra mecanismos neurodegenerativos, mas os resultados ainda não foram confirmados por outros grupos de pesquisa. Em outro estudo neuropsicológico individual, efeitos de melhoria do humor com melhora simultânea nas habilidades cognitivas foram observados pela administração de EPO em pacientes com estados de ansiedade e depressão .
Outras abordagens de tratamento experimental
As propriedades citoprotetoras da EPO não se limitam apenas ao tecido neuronal. Após o tratamento com EPO, as células do músculo cardíaco também são significativamente menos sensíveis a fatores de estresse letais , tais como aqueles causados por, e. B. ocorrer em um ataque cardíaco devido ao suprimento insuficiente de oxigênio ( hipóxia ). Dessa forma, a EPO poderia ser administrada preventivamente em pacientes de risco. No entanto, mesmo após a ocorrência de um infarto isquêmico, o uso de EPO pode ser útil, pois as células do músculo cardíaco estão protegidas de danos adicionais usuais durante a reperfusão do órgão. Num estudo realizado na Suíça poderia ser demonstrado que este efeito protector é baseado na produção de EPO-mediada de óxido nítrico nas coronárias células endoteliais . A vasodilatação causada pelo óxido nítrico aparentemente leva a um maior fluxo sanguíneo e, portanto, a um melhor suprimento de oxigênio ao tecido. Em um primeiro estudo com 138 pacientes no tratamento de infarto do miocárdio com EPO, entretanto, nenhum benefício da administração da citocina pode ser observado. O mesmo se aplica ao tratamento da insuficiência cardíaca acompanhada de anemia.
No modelo de camundongo, pode ser demonstrado que a EPO tem uma influência positiva nos processos de cicatrização de feridas : uma dose única alta da citocina EPO acelera, entre outras coisas, a epitelização e diferenciação do sistema microvascular de vasos sanguíneos . A transferibilidade dos resultados para humanos está sendo investigada como parte de um estudo multicêntrico.
Em um estudo de longo prazo no Children's Hospital auf der Bult , Hanover, foi demonstrado que a EPO pode proteger contra hemorragia cerebral em bebês extremamente prematuros .
O Instituto Max Planck de Medicina Experimental em Göttingen planejou um estudo randomizado em 2020 sobre o uso de EPO para melhorar os sintomas durante o curso de COVID-19 .
Nome e propriedades das preparações de EPO

Em 1989, a Organização Mundial da Saúde ( OMS ) introduziu uma nomenclatura INN para variantes de EPO recombinantes . Então, todas as substâncias com o mesmo mecanismo de ação da eritropoietina recebem a palavra raiz “-poetina”. "Epoetina" é um ingrediente ativo que tem a mesma sequência de aminoácidos incluindo pontes dissulfeto e locais de glicosilação que a eritropoietina humana natural. No entanto, todas as variantes da EPO recombinante diferem da molécula endógena nativa na composição das estruturas de açúcar ( padrão de glicosilação ). Existem também diferenças entre as variantes recombinantes. Para distinguir as variantes, uma letra grega é adicionada ao termo “Epetina”. As seguintes variantes de EPO estão atualmente listadas pela OMS de acordo com a nomenclatura INN: epoetina alfa (epoetina α), epoetina beta (epoetina β), epoetina gama (epoetina γ), epoetina delta (epoetina δ), epoetina epsilon (epoetina ε) , Epoetina zeta (epoetina ζ), epoetina teta (epoetina θ), epoetina kappa (epoetina κ) e epoetina ômega (epoetina ω).
O veículo de expressão recombinante para a produção das variantes epoetina α e β é, cada um, um subclone geneticamente modificado de uma linha celular ovariana do hamster chinês ( Cricetulus griseus ), uma chamada linha celular CHO ( Ovário do Hamster Chinês ). Uma linha celular geneticamente modificada e subclonada do rim de um jovem hamster dourado sírio ( Mesocricetus auratus auratus ) é usada para produzir a variante epoetina ω ( células BHK , rim de hamster bebê ).
Em comparação com a epoetina α, a epoetina β tem um peso molecular ligeiramente superior, um espectro mais amplo de isoformas básicas e, portanto, um grau ligeiramente inferior de sialilação. No entanto, a proporção de cadeias laterais tetra-sialiladas é mais de duas vezes mais alta na epoetina β do que na epoetina α. Após a desialilação, a epoetina β mostrou uma atividade farmacológica 20 por cento maior em comparação com a epoetina α no modelo de camundongo . Epoetina ω, devido às diferentes linhas celulares de expressão, difere estruturalmente das variantes α e β na sequência dos monômeros de açúcar e no número de ramificações nas cadeias laterais de açúcar (antenas).
A epoetina γ é expressa por uma linha celular de fibroblasto murino recombinante , a epoetina ε por uma linha BHK (compare a epoetina ω). Ambas as variantes, no entanto, como a variante epoetina κ, aparentemente não têm relevância clínica.
A Epoetina ζ ( Silapo ou Retacrit ) da Stada / Hospira e a Epoetina α da Hexal / Sandoz ( Epoetina alfa Hexal , Binocrit ) são produtos imitadores da preparação Epoetina α Erypo / Eprex da Janssen Cilag. Em comparação com Erypo / Eprex , os produtos imitadores contêm menos O-glicanos e menos dos indesejáveis derivados do ácido siálico, ácido N-glicolilneuramínico e ácido O-acetilneuramínico.
A quantidade de EPO é fornecida em Unidades Internacionais (IU) em vez de gramas ou moles , uma vez que a EPO nativa ou recombinante são misturas de isoformas de diferentes atividades biológicas . Por definição, uma unidade de EPO no modelo de roedor tem o mesmo efeito eritropoiético que 5 micromoles de cloreto de cobalto . EPO humana isolada de urina foi inicialmente usada como material de referência. Em 1992, a OMS desenvolveu seu próprio padrão de referência para EPO recombinante. A Direcção Europeia para a Qualidade dos Medicamentos estabeleceu novamente um padrão de referência separado para a EPO terapêutica recombinante (o chamado padrão BRP, BRP = preparação de referência biológica ). Esta é uma mistura 1: 1 de epoetina α e epoetina β.
Compostos de EPO de primeira geração
Em contraste com a insulina , que vinha do pâncreas dos porcos antes do uso de preparações de insulina recombinante (ver Organon ), não havia essa origem “arcaica” para a EPO. Foi somente com o isolamento do gene da EPO e sua clonagem e expressão em células de mamíferos que foi possível, com o auxílio de processos de fabricação biotecnológicos, produzir o hormônio em quantidades suficientes para a terapia.
- A empresa americana de biotecnologia Amgen lançou a primeira preparação de EPO recombinante ( Epogen , Epoetina α) no mercado em 1989 . Em estudos clínicos das fases I e II de 1986 em diante na Universidade de Washington em Seattle, pode ser demonstrado que a terapia da anemia com EPO recombinante em pacientes com câncer e rins tem significativamente menos efeitos colaterais do que os tratamentos com transfusões de sangue . A situação da patente permitiu à Amgen comercializar exclusivamente preparações de EPO nos EUA até 2015 (de acordo com outra fonte, a patente da Amgen expirou em 2011). O licenciado da Amgen no Japão é o grupo cervejeiro Kirin , cuja divisão farmacêutica vende a variante da epoetina α sob o nome comercial ESPO desde 2001 . Em outubro de 2004, a Kirin anunciou que encerraria sua cooperação com a empresa farmacêutica japonesa Daiichi Sankyo na distribuição de ESPO no mercado asiático em março de 2005.
- A empresa farmacêutica norte-americana Johnson & Johnson desenvolveu uma epoetina α sob a licença Amgen, que está disponível sob o nome comercial Procrit e Eprex fora dos Estados Unidos. Na Alemanha e na Áustria, a preparação é vendida com o nome comercial Erypo pela Janssen Cilag ( Ortho Biotech ), uma subsidiária da Johnson & Johnson. Outros nomes comerciais para vendas na Itália são Epoxitin e Globuren . Em Espanha e Portugal, a Eprex está também no mercado com a designação Epopen da empresa Esteve (Laboratorios Pensa) . Na Polónia, Rússia e Ucrânia, a preparação é comercializada pela Jelfa Pharmaceuticals com o nome de Epoglobina . Também na Polónia, a preparação Epox no distribuidor de medicamentos Genexo no mercado. Na Bolívia, uma preparação chamada Eritrogen produzida pelos Laboratórios Bagó está disponível.
- Em 1990, a Boehringer Mannheim lançou uma preparação de epoetina-β sob o nome de NeoRecormon . Em 1997, quando a Boehringer Mannheim foi comprada pela Hoffmann-La Roche , a empresa farmacêutica recebeu a aprovação da Agência Europeia de Medicamentos para introdução em toda a Europa. No Japão, a Chugai , uma empresa farmacêutica que faz parte da Hoffmann-La Roche desde 2002, também fabrica uma preparação de epoetina-β com o nome comercial de Epogin desde 1990 .
Compostos de EPO de próxima geração
O enorme sucesso das primeiras preparações de EPO significou que (como nenhum outro fator de crescimento produzido de forma recombinante) numerosas estratégias foram desenvolvidas para aumentar a atividade biológica da molécula de EPO, para facilitar seu uso e para melhorar sua tolerabilidade. Um foco foi nas modificações estruturais da molécula inicial (palavras-chave: engenharia de proteínas, design de proteínas). Além disso, novas áreas de terapia poderiam ser definidas por meio de novas descobertas da pesquisa médica básica. Os desenvolvimentos mais recentes nesta área incluem análogos de EPO (também referidos como "miméticos" em inglês), abordagens de terapia genética para aumentar a disponibilidade de EPO no organismo e preparações de combinação que devem ser usadas, por exemplo, para tratar doenças neurodegenerativas.
Modificações da molécula de EPO
- Em 2001, a Amgen gerou uma eritropoietina geneticamente modificada com o nome comercial de Aranesp (darbepoetina α). Ao trocar cinco aminoácidos, ele contém cadeias laterais de açúcar adicionais, o que aumenta a proporção de ácidos siálicos terminais e, portanto, a meia-vida sérica por um fator de cerca de três. É o primeiro dos compostos de EPO de próxima geração a ser aprovado terapeuticamente. O licenciado da Amgens Darbepoetina α na Itália é a Dompe Biotec , que vende o produto com o nome de Nespo . A darbepoetina α é produzida em células CHO. Em 2004, a Amgen iniciou um estudo de Fase I de um análogo hiperglicosilado de Aranesp com a identificação “AMG114” no tratamento de anemia induzida por quimioterapia. Em junho de 2006, uma equipe internacional de pesquisadores apresentou os resultados de um estudo multicêntrico de fase III no 43º Congresso da Sociedade Americana de Oncologia Clínica (ASCO), segundo o qual "AMG114" com meia-vida sérica de 131 horas parece ser mais adequado do que a quimioterapia ao mesmo tempo. Formas tumorais ( câncer de mama , câncer de cólon , linfoma não-Hodgkin ) a serem utilizadas. Outros estudos mostraram, no entanto, que a molécula tem muito pouca afinidade para o receptor da EPO. Portanto, todos os estudos clínicos com "AMG114" foram encerrados.
- Sob o aspecto de uma maior duração de ação, a Hoffmann-La Roche desenvolveu o derivado de EPO CERA ( Continuous Erythropoiesis Receptor Activator , identificador interno da Roche: Ro 50-3821), no qual a molécula de EPO (a epoetina β conhecida a partir da preparação NeoRecormon ) está ligado a um polímero de metoxipolietilenoglicol na alanina N-terminal (ALA 1) ou em um dos resíduos de lisina (LYS 45 ou LYS 52) (denominado PEGuilação ). Devido à ligação do polímero, o CERA tem uma massa molecular de 66 kDa e é, portanto, quase duas vezes maior que a EPO nativa. De acordo com estudos de fase clínica II, a meia-vida sérica após a administração intravenosa é de cerca de 133 horas e, portanto, mais de cinco vezes maior do que com a darbepoetina α. De acordo com estudos farmacocinéticos, o efeito do CERA é determinado por uma ligação mais fraca da molécula ao receptor da eritropoietina. Após a ligação, o CERA também é liberado mais rapidamente do receptor da EPO. CERA também está atualmente em um ensaio clínico (fase III) no tratamento de linfoma não-Hodgkin . Em abril de 2006, foi apresentado um pedido à Agência Europeia de Medicamentos para comercializar a preparação sob o nome comercial Mircera . Em julho de 2007, foi aprovado pela Comissão Europeia para o tratamento da anemia na doença renal crônica (DRC), segurança e eficácia não foram comprovadas nas outras indicações. Dois estudos clínicos controlados nos quais o Mircera foi usado em pacientes com vários tipos de câncer, incluindo câncer de cabeça e pescoço e câncer de mama, mostraram um aumento inexplicável na mortalidade. Em novembro de 2007, o FDA aprovou o Mircera nos Estados Unidos para o tratamento da anemia renal com uma dose de manutenção uma vez por mês.
- Outras empresas, como Bolder Biotechnology (com BBT-009), PolyTherics (com Epo TheraPEG), Prolong Pharmaceuticals (com EPEG), Neose (com NE-180 = EPO peguilado de células de inseto), Lipoxen (ErepoXen, ácido polissialico em vez de polietileno glicol como polímero de peguilação) e a empresa Complex Biosystems, sediada em Heidelberg (PEGilação reversível para liberação controlada do ingrediente ativo). Em fevereiro de 2008, a Neose anunciou que as atividades de seu produto NE-180 serão interrompidas devido às discussões de segurança em andamento sobre o uso de substâncias eritropoiéticas e a resultante falta de perspectivas de mercado. Em abril de 2008, o Lipoxen anunciou a conclusão bem-sucedida de um estudo de Fase I com ErepoXen conduzido na Índia e anunciou o início de um segundo estudo de Fase I no Canadá em junho de 2008. Um primeiro estudo de fase II com a preparação deve ser iniciado na Índia no segundo trimestre de 2009. A empresa espera que o ErepoXen seja lançado na Rússia em 2011.
- No qual, pela firma norte-americana CoGenesys desenvolveu a preparação Albupoetin a molécula de EPO está ligada a uma molécula de albumina humana. Tal como acontece com a PEGuilação, esta modificação aumenta a duração da ação, pois a EPO é mais lentamente esgotada da corrente sanguínea através dos rins. De acordo com as informações da empresa , a albupetina demonstrou sua eficácia em vários estudos in vitro e in vivo . A técnica de ligação de albumina também é usada por CoGenesys para outros agentes terapêuticos (por exemplo , somatropina , G-CSF , BNP e insulina ). Em janeiro de 2008, a CoGenesys foi adquirida pela fabricante israelense de genéricos Teva .
- A empresa DNAPrint Genomics, sediada na Flórida, está atualmente trabalhando em estudos pré-clínicos sob a ID “PT-401” em uma preparação de dímero de EPO que se diz ter uma afinidade significativamente maior para o receptor de EPO do que a EPO nativa. Em fevereiro de 2008, a DNAPrint Genomics foi adquirida pela empresa farmacêutica norte-americana Nanobac Pharmaceuticals .
- A empresa norte-americana Syntonix está trabalhando no desenvolvimento de uma preparação para inalação baseada em sua tecnologia patenteada de Transceptor . Neste caso, a molécula de EPO (unidade funcional) é ligada ao fragmento cristalino (Fc) de um anticorpo (unidade de transporte) para formar uma proteína de fusão (denominada Epo-Fc). Como o epitélio pulmonar tem uma alta densidade de receptores que interagem com o fragmento Fc (denominado FcRn), o Epo-Fc, administrado como um spray inalatório, é rapidamente absorvido nos pulmões e transportado para a corrente sanguínea . A unidade Fc da proteína de fusão também garante que a meia-vida sérica seja significativamente mais longa do que a da molécula de EPO “nua”. Por um lado, isso se deve ao aumento do tamanho molecular (ver CERA de Hoffmann-La Roche), que impede que seja liberado pelos rins. Por outro lado, o Epo-Fc é liberado de volta na corrente sanguínea após a endocitose pelos eritroblastos por meio da rota de reciclagem endossômica e, portanto, está novamente disponível. O Epo-Fc está em fase de ensaio clínico (fase clínica I). Em 1o de fevereiro de 2007, a Syntonix se tornou uma subsidiária do grupo de biotecnologia Biogen Idec .
O concorrente da Syntonix nesta área é a Bolder Biotechnology , que também desenvolveu uma Epo-Fc (chamada ImmunoFusion Protein, identificador: BBT-021). - A empresa americana de biotecnologia Warren Pharmaceuticals , juntamente com a farmacêutica dinamarquesa H. Lundbeck A / S, desenvolveu um derivado de EPO que supostamente ajuda no tratamento de doenças neurodegenerativas . Na preparação CEPO (abreviação de EPO carbamilada ), um resíduo carbamil foi acoplado a todos os monômeros de lisina da molécula de EPO, o que aumenta sua afinidade para receptores neuronais específicos. Em contraste com a molécula de EPO nativa, CEPO não tem propriedades eritropoiéticas . Em vez disso, o efeito da preparação é baseado em efeitos antiapoptóticos, que evitam a morte do tecido miocárdico e neuronal. Os primeiros sucessos no tratamento de derrames isquêmicos e encefalite foram alcançados em modelos de camundongos e ratos . O mesmo se aplica à terapia de enfarte do miocárdio no modelo do rato. Em outubro de 2007, o CEPO foi usado pela primeira vez na fase clínica I.
- A empresa farmacêutica israelita Modigene (renomeado PROLOR Biotech desde Junho de 2009 ) desenvolveu um preparado de EPO (MOD-7023) em que a molécula de EPO é acoplado a um péptido carboxi-terminal da gonadotrofina coriónica humana . MOD-7023 mostrou uma meia-vida sérica prolongada e uma atividade farmacológica mais elevada em comparação com as preparações padrão. A empresa também aplica esta técnica à modificação estrutural de outras hormonas terapêuticas ( somatotropina , interferão-β ).
Variantes de EPO "naturais"
- Uma joint venture das empresas Sanofi-Aventis e da empresa norte-americana Transkaryotic Therapies ( adquirida desde 2005 pela fabricante farmacêutica britânica Shire Pharmaceuticals ) comercializou um por ativação gênica via transfecção de um promotor viral ( CMV) (da linha celular humana transformada HT-1080 , isolado de um fibrossarcoma acetabular ) produziu uma variante de EPO sob a marca DynEpo (Epoetina δ). A Shire publicou pela primeira vez os resultados de estudos de Fase III bem-sucedidos em setembro de 2006. Em 15 de março de 2007, o DynEpo foi lançado no mercado alemão. Outros países europeus seguiram em 2007. Em 31 de julho de 2008, a Shire anunciou que encerraria a produção de DynEpo no final de 2008.
- A empresa francesa de biotecnologia GenOdyssee descobriu uma variante natural da EPO caracterizada por um chamado SNP , que em experimentos in vitro tem uma atividade 30-50% maior do que a da EPO nativa. A variante conhecida como "GO-EPO" mostra uma mudança na configuração perto do local de ligação do receptor da EPO simplesmente pela troca de um aminoácido singular na estrutura terciária , o que aumenta significativamente a afinidade da molécula para o receptor.
- A empresa norte-americana GlycoFi conseguiu gerar uma EPO humanizada em leveduras do gênero Pichia , em particular Pichia pastoris . Ao introduzir elementos genéticos de nocaute e sequências de genes específicos para humanos nas células de levedura, foi possível prevenir a glicosilação específica para leveduras durante a modificação pós-tradução e, em troca, introduzir etapas de glicosilação específicas para humanos. Em maio de 2006, a GlycoFi foi adquirida pela empresa farmacêutica norte-americana MSD Sharp & Dohme . O uso de uma forma peguilada do EPO humanizado (identificador: MK2578) foi investigado em estudos clínicos de fase II. No entanto, o desenvolvimento foi interrompido em 2010.
- Por mais de uma década, houve esforços para produzir EPO com a ajuda de animais transgênicos (gado, porcos, cabras, ovelhas). Pesquisadores japoneses da Universidade de Nagoya tiveram sucesso pela primeira vez na produção de EPO humana com a ajuda de galinhas transgênicas. O hormônio é isolado dos ovos dos animais. A atividade biológica da EPO obtida desta forma in vitro é comparável à das EPOs recombinantes comuns de células CHO. No entanto, a glicosilação é incompleta - os ácidos siálicos terminais geralmente estão ausentes.
Miméticos de EPO
- Em San Francisco baseados empresa biofarmacêutica Gryphon Therapeutics (anteriormente Ciências Gryphon ), a primeira S ynthetische E rythropoese- P rotein ( setembro desenvolvida). SEP é uma macromolécula totalmente sintética, consistindo em uma estrutura polipeptídica com monômeros de 166 aminoácidos, que possui uma alta homologia de sequência com a molécula de EPO nativa. Este polipeptídeo contém dois monômeros de lisina não naturais (Lys 24 (Nε-levulinil) e Lys 126 (Nε-levulinil)), por meio dos quais está quimicamente ligado a um polímero carregado negativamente de um comprimento definido. A atividade do SEP in vitro é comparável à da EPO. Em contraste, a meia-vida sérica é cerca de 2,5 vezes mais longa. A Hoffmann-La Roche adquiriu a licença para usar a proteína em campos de terapia clássica de EPO já em 2002 .
- A empresa americana Affymax desenvolveu uma preparação análoga ao EPO sob o nome de Hematide ™ ( INN Peginesatide, novo nome comercial: Omontys ™). O ingrediente ativo é um polipeptídeo cíclico de cadeia curta com uma ponte dissulfeto , cujo modo de ação corresponde ao da EPO nativa, mas cuja sequência de aminoácidos não mostra homologia com a molécula de EPO nativa. Para evitar a rápida excreção pelos rins e para estabilizar a estrutura, o peptídeo também é PEGuilado . Em março de 2012, o Omontys ™ recebeu aprovação dos EUA para o tratamento da anemia renal. Em fevereiro de 2013, o fabricante anunciou um recall do produto porque alguns pacientes tiveram reação anafilática , algumas das quais fatais .
- A empresa canadense ProMetic Biosciences desenvolveu “PBI-1402”, um análogo de EPO de baixo peso molecular que demonstrou efeitos estimulantes e antiapoptóticos na formação de eritrócitos e granulócitos em estudos clínicos de fase I. A substância está sendo investigada em estudos clínicos de fase II em pacientes com anemia causada por agentes quimioterápicos. Os primeiros resultados desses estudos foram publicados no 13º Congresso da Sociedade Europeia de Hematologia em Copenhague, em junho de 2008.
- A empresa biofarmacêutica alemã AplaGen Biopharmaceuticals de Baesweiler, perto de Aachen, desenvolveu um imitador de EPO, HemoMer ™, no qual o peptídeo funcional está ligado a uma macromolécula à base de polissacarídeo. Como no caso dos PEGilatos, o aumento do tamanho das moléculas tem como objetivo retardar a excreção pelos rins. O chamado princípio de supravalência também garante que, em contraste com a PEGuilação, por um lado, a eficácia é aumentada e, por outro lado, o carreador do ingrediente ativo também é decomposto no corpo. A preparação está atualmente em estudos pré-clínicos e até agora pode ser usada por via intravenosa , bem como por via parenteral . A empresa também está trabalhando em outros miméticos de citocinas e formas farmacêuticas alternativas. Em 2010, a empresa teve que pedir concordata.
- A empresa Abbott Laboratories desenvolveu anticorpos terapêuticos humanizados (ABT007) que causam em estudos pré-clínicos em um modelo de camundongo pela ligação ao receptor da EPO, a maturação das células progenitoras em eritrócitos e, portanto, um aumento no hematócrito. Devido às propriedades especiais de ligação do anticorpo, a administração é menos frequente do que com preparações de EPO padrão.
- A ligação da EPO ao seu receptor associado (EpoR) pode ser evitada por certas substâncias, que por sua vez se ligam ao receptor em vez da EPO (ver inibição competitiva ). A empresa farmacêutica norte-americana Merck identificou tal substância (N-3- [2- (4-bifenil) -6-cloro-5-metil] indolil-acetil-L-lisina metil éster) usando um processo de seleção competitivo que no modelo de cultura de células como uma molécula de octâmero (conexão em forma de estrela de oito moléculas individuais por meio de uma "molécula de núcleo" central, designação: "Composto 5") causa uma resposta do receptor idêntica à EPO (homodimerização e subsequentes cascatas de transdução de sinal). "Composto 5" é totalmente sintética e é a única ESA a data , cujo efeito é mediado directamente através do receptor da EPO, sem um amino ácido espinha dorsal . Isso estaria em contraste com z. Por exemplo, a administração oral também é concebível além das preparações padrão de EPO (consulte também a seção sobre formas de dosagem ). Outros estudos no uso pré-clínico ou clínico do "Composto 5" ainda não foram publicados.
- A empresa de biotecnologia dos EUA Centocor desenvolveu uma proteína de fusão de anticorpo mimético de EPO com o identificador "CTNO 528" sem qualquer semelhança estrutural com a eritropoietina. No modelo do rato, "CTNO 528" foi bem sucedido no tratamento da aplasia eritrocitária . Num primeiro estudo de fase I em humanos, a preparação foi capaz de aumentar o número de reticulócitos e a concentração de hemoglobina de uma forma dependente da dose .
- A empresa farmacêutica norte-americana Ligand Pharmaceuticals está trabalhando no desenvolvimento de um mimético de EPO não peptídico administrado por via oral.
Terapia de genes
- A empresa britânica Oxford BioMedica está buscando uma abordagem de terapia genética com sua preparação Repoxygen na fase pré-clínica. A droga é administrada por via intramuscular e contém lançadores de genes adenovirais , com a ajuda dos quais o gene EPO é transferido para as células musculares. A expressão do gene EPO é controlada por um fator de transcrição sensível ao oxigênio. Desta forma, a EPO é formada apenas nas células musculares transfectadas quando a saturação de oxigênio no sangue cai abaixo de um valor crítico. Como parte do processo contra o treinador de atletismo Thomas Springstein por suspeita de doping genético em janeiro de 2006, o fundador da empresa Alan Kingsman anunciou que a Oxford BioMedica havia cessado a produção do ingrediente ativo até novo aviso.
- A empresa farmacêutica norte-americana Medgenics está trabalhando no desenvolvimento de uma chamada "biopump". Tecido subdérmico , denominado “microrganismo”, é retirado do paciente sob anestesia local por meio de biópsia minimamente invasiva . O microrganismo obtido desta forma é então transfectado com o gene EPO usando vetores adenovirais. As células geneticamente modificadas dessa maneira produzem então a proteína desejada (eritropoietina). Após algumas etapas intermediárias para remover o excesso de adenovírus e para testes funcionais, o microrganismo é transplantado de volta para o paciente (o chamado transplante autólogo ). De acordo com informações da Medgenics, a função dessa biobomba será mantida por um período de 6 meses. Em março de 2009, a Medgenics relatou os resultados bem-sucedidos de um estudo de fase I / II de sua terapia EPODURE. De acordo com isso, um paciente já convivia com três transplantes de EPODURE há 11 meses sem qualquer fornecimento externo de EPO.
- Em 5 a 10% dos pacientes em diálise nos quais a eritropoiese não responde apesar do tratamento com preparações de EPO em altas doses (chamadas de hiporresponsividade da EPO), a razão para isso é uma expressão aumentada da proteína SHP-1. SHP-1 é uma proteína fosfatase que evita que a cascata de transdução de sinal JAK-STAT ocorra em células precursoras hematopoiéticas do tipo BFU-E por desfosforilação da enzima Janus quinase 2 após a EPO se ligar ao seu receptor e, assim, impede que as células precursoras de eritrócitos (consulte o capítulo Função biológica ). Um grupo de pesquisa japonês foi capaz de mostrar que a introdução de RNA antisense em células precursoras do tipo BFU-E, que haviam sido previamente isoladas de pacientes em diálise hiporresponsiva à EPO, impede a biossíntese de proteína de SHP-1 por meio de ligação complementar ao associado mRNA . As células progenitoras tratadas desta forma continuam o processo de maturação controlado pela EPO. Em vez de tal abordagem de terapia gênica, no entanto, os autores propõem a identificação de substâncias que inibem a atividade de SHP-1. Estas substâncias podem incluir 4-hidroxinonenal , cujo efeito inibidor sobre SHP-1 em concentração fisiológica já foi descrito.
Indutores de síntese de EPO
- A empresa norte-americana FibroGen está trabalhando no desenvolvimento de um medicamento denominado "FG-2216". A substância inibe a função da enzima prolil hidroxilase , que é responsável pela quebra do chamado “fator induzido por hipóxia” (HIF abreviado, consulte o capítulo sobre biossíntese ). Como resultado da estabilização de HIF alcançada desta forma, o gene da EPO é superexpresso. O preparado “FG-4592”, também desenvolvido pela FibroGen e destinado ao tratamento da chamada síndrome da DAC ( Anemia de Doença Crônica ) , também possui um modo de ação correspondente . Além disso, ambas as substâncias parecem promover a expressão de outros genes importantes para a eritropoiese (receptor da EPO, transferrina , receptor da transferrina , ferroportina ). Em abril de 2006, a empresa farmacêutica japonesa Astellas adquiriu os direitos de venda de ambos os produtos fora dos Estados Unidos.
- A preparação "AKB-6548" da empresa norte-americana Akebia Therapeutics é também um inibidor da prolil hidroxilase. Em setembro de 2009, a Akebia anunciou um estudo de Fase I de administração oral em pacientes com doença renal crônica e pacientes em pré-diálise.
- A empresa farmacêutica sul-coreana CrystalGenomics também está trabalhando em concorrência com suas contrapartes americanas no desenvolvimento de terapêuticas que estabilizam o efeito da proteína HIF. A Palkon Inc. , uma joint venture entre a CrystalGenomics e a empresa de capital de risco ProQuest Investment , anunciou em junho de 2009 o início dos estudos pré-clínicos com preparativos para a estabilização do HIF.
- Com a participação da fabricante de medicamentos Kowa Pharmaceutical , está sendo realizado no Japão um preparado denominado "K-11706". O efeito da preparação é baseado na inibição do fator de transcrição GATA2, que evita a expressão da eritropoietina ao se ligar ao promotor da EPO. K-11706 destina-se a ser usado terapeuticamente para o tratamento da síndrome ACD (ver acima), em que citocinas inflamatórias, como interleucina 1-β e TNF-α, promovem a ligação ao DNA de GATA2. Sucessos iniciais foram alcançados no modelo de camundongo após a administração oral.
Proteínas EPO quiméricas e terapias de combinação
- Em 1999, a empresa farmacêutica italiana Menarini patenteou a produção de uma proteína de fusão em células CHO, que é composta de EPO e do "fator estimulador de colônia de granulócitos-macrófagos" (abreviadamente GM-CSF) (patente US 5.916.773). A proteína de fusão com a designação "MEN 11303" alcançou em estudos in vitro uma melhora significativa na expansão das células progenitoras eritróides em comparação com as doses equimolares dos fatores individuais. Atualmente está sendo investigada a possibilidade da preparação na propagação ex vivo de células-tronco humanas.
- Com o NTx-265, a empresa canadense Stem Cell Therapeutics desenvolveu um método de tratamento no qual a administração combinatória de hCG ( gonadotrofina coriônica humana ) e EPO em um modelo animal teve sucesso no tratamento de derrames. Um estudo de fase II bem-sucedido em pacientes foi relatado em fevereiro de 2008.
- Cientistas do Hospital Universitário Lausanne (CHUV) descobriram em um modelo de camundongo que a proteína Gas6 tem um efeito positivo na formação de glóbulos vermelhos. Em camundongos saudáveis que receberam EPO, certas células progenitoras dos eritrócitos (os chamados eritroblastos ) produziram a referida proteína. O Gas6, por sua vez, resultou em uma taxa de resposta melhorada dos camundongos à EPO em termos de formação de novos glóbulos vermelhos. Em camundongos com anemia aguda e crônica que não responderam à EPO sozinha, a adição de Gas6 aumentou o hematócrito. Com base nesses resultados em experimentos com animais, os autores presumem que, no futuro, o Gas6 sozinho ou em conjunto com a EPO pode ser usado em terapias de anemia para pacientes nos quais a administração de EPO isolada não teve sucesso até agora.
Produtos imitadores (biogenéricos, biossimilares, biológicos de continuação)
O desenvolvimento e o uso de biofármacos na medicina desde a década de 1980 levaram a avanços significativos na terapia de doenças graves, como distúrbios metabólicos, bem como câncer e doenças autoimunes. No entanto, os biofármacos são muito caros e podem custar 25 vezes mais que um medicamento convencional, o que pode representar uma sobrecarga significativa para o sistema de saúde. A expiração das patentes para alguns biofármacos (incluindo EPO) desde 2004 e as diretrizes emitidas pela Agência Europeia de Medicamentos para produtos biológicos semelhantes em geral e as diretrizes para medicamentos biológicos semelhantes contendo eritropoietina recombinante em particular para fabricantes de medicamentos genéricos autorizados a entrar no negócios com EPO e outros produtos biofarmacêuticos (consulte o capítulo Dados de mercado para preparações de EPO ). Devido às altas demandas de know-how e aos altos custos de desenvolvimento, no entanto, apenas alguns fabricantes de genéricos podem fazer isso. Em alguns países fora da União Europeia, bem como na Ásia, África e América do Sul, os genéricos EPO ( biossimilares ) estavam disponíveis em um estágio inicial. Em muitos casos, faria mais sentido falar de plágio de EPO para produtos fora da União Europeia , uma vez que as preparações de EPO correspondentes já estão em circulação há muitos anos e as patentes e licenças não foram levadas em consideração em sua fabricação e distribuição. Nos EUA, a Amgen atualmente possui direitos de distribuição exclusivos devido à situação da patente. Diretrizes de aprovação rígidas e padronizadas para a introdução de medicamentos imitadores, conforme publicadas pela Agência Europeia de Medicamentos, foram anunciadas pelo FDA em 2003 , mas ainda não foram implementadas. Após a mudança de governo nos EUA e a meta declarada do presidente Barack Obama de reduzir drasticamente os custos dos medicamentos, o primeiro passo para a introdução de medicamentos genéricos foi apresentado ao Congresso dos EUA em março de 2009 pela chamada Lei do Biossimilar . As audiências da FDA foram realizadas em novembro de 2010. Os primeiros biossimilares da EPO foram aprovados na UE em agosto de 2007.
Até agora, nenhum termo uniforme foi estabelecido para produtos imitadores de proteínas altamente complexas. No entanto, o termo biossimilar é mais comumente usado na literatura científica . O nome se refere à alta similaridade entre o biossimilar e seu produto de referência (similar = inglês para "similar"), que é comumente referido como a preparação original ou original . O fato de a preparação original e o biossimilar não poderem ser cem por cento idênticos se deve à natureza especial do processo de fabricação. Como o ingrediente ativo é produzido biotecnologicamente, a réplica depende crucialmente das especificações do processo de fabricação. Isso inclui, entre outras coisas, a seleção da linha celular, a escolha da planta de produção, a composição da substância nutritiva e as condições de temperatura e pressão durante a produção. Todos os biofármacos de um grupo de ingredientes ativos diferem ligeiramente. Isso se aplica não apenas aos biossimilares e seu produto de referência, mas também aos produtos originais entre si. Por serem obtidos de células vivas, sempre há pequenas diferenças, por exemplo, entre lotes de um único fabricante ou entre fabricantes do mesmo ingrediente ativo.
Na Europa, o processo de fabricação é monitorado de perto para garantir a maior semelhança possível entre o biossimilar e seu produto de referência. Ele está sujeito às mesmas diretrizes de qualidade rígidas que se aplicam às preparações originais. Antes de um biossimilar chegar ao mercado europeu, os fabricantes de biossimilares devem realizar um programa de estudos abrangente. O tipo e a execução dos estudos de biossimilares são prescritos pela Agência Europeia de Medicamentos (EMA) e os resultados são verificados como parte do processo de aprovação. A aprovação é um pré-requisito para uso terapêutico. O termo "biogenérico" (plural: "biogenerics") é usado ocasionalmente e é uma caracterização inadequada desta classe de drogas regulatórias (termo americano: "follow-on biologics").
Ásia
- Desde 2000, várias empresas farmacêuticas indianas têm entrado no mercado interno com seus próprios preparos. Estas incluem as empresas Emcure com as preparações Vintor e Epofer, Wockhardt com Wepox, Zydus Biogen com Zyrop, Ranbaxy com a preparação Ceriton, Shantha Biotechnics com Shanpoietin e Intas Pharmaceuticals com as preparações Epofit e Erykine, Claris Lifesciences com Epotin e Zuventus com Eporise. De acordo com a empresa, a maior instalação de produção para a produção de proteínas recombinantes (incluindo EPO) pela Biocon, empresa de biotecnologia sediada em Bangalore, foi inaugurada em abril de 2006. A Biocon agora comercializa a preparação de EPO ERYPRO . Em junho de 2009, a Biocon firmou parceria estratégica com a farmacêutica norte-americana Mylan para vendas nos Estados Unidos. A fabricante de medicamentos Reliance Life Sciences , que surgiu a partir da aquisição da empresa britânica GeneMedix pela empresa indiana Reliance Industries , vende a preparação de EPO ReliPoietin desde 2008 .
- A empresa farmacêutica canadense Dragon Biotech, com sede em Vancouver, produz um EPO genérico em uma instalação em Nanjing (China) desde 2004 e o vende na China, Índia, Egito, Brasil, Peru, Equador, Trinidad e Tobago e também na República Dominicana República e Kosovo. A empresa também anuncia o desenvolvimento de um novo produto EPO para o mercado europeu.
- Além da Dragon Biotech , outras empresas estão representadas no mercado chinês com preparações de EPO. Isso inclui as empresas de Hong Kong Refinex Medical e Medichem , bem como SciProgen (preparação: SEPO ), Beijing Four Rings Biopharmaceuticals , Shandong Kexing Bioproducts (preparação: EPOSINO ), Kelun Biopharmaceuticals , Chengdu Diao , Shanghai Ke-hua , Shangdong Ahua , Shenzhen Xinpeng , Shanghai Sanwei e 3SBio Shenyang Sunshine Pharmaceuticals (abreviação: SSP ). A empresa PlasmaSelect de Munique pretende comercializar a preparação EPO EPIAO distribuída pela SSP na Europa, que tem uma quota de mercado de cerca de 40% na China. A empresa farmacêutica baseada em Shijiazhuang North China Pharmaceutical Group Corporation (NCPC), o maior produtor de antibióticos da China , comercializa um composto de EPO produzido por sua joint venture GeneTech Biotechnology sob o nome comercial GerEpo .
- No Vietnã, a empresa Nanogenpharma, com sede na cidade de Ho Chi Minh, produz uma preparação EPO-α sob o nome de Bioetina .
- A preparação de EPO Epokine (EPO α) da empresa biofarmacêutica CJ Corp encontra-se no mercado sul-coreano . Epokine também está disponível em outros países asiáticos ( por exemplo, Paquistão e Filipinas) e América do Sul ( por exemplo, Chile) através de distribuidores locais. A preparação Eporon é comercializada pelo concorrente doméstico da CJ Corps, Dong-A Pharmaceutical . Na região da América do Sul e Pacífico, a Eporon está no mercado com o nome Eritina através da empresa colombiana Chalver Laboratorios . Uma terceira empresa é a LG Lifescience with Espogen , que também é comercializada na Índia pela subsidiária LG Lifescience India . Existe um acordo de cooperação entre a LG Lifescience e a desenvolvedora suíça de biogenéricos Biopartners para a introdução planejada de Espogen e outros biofármacos na União Europeia desde 2000 .
- Em 5 de fevereiro de 2007, de acordo com o chefe do Instituto Pasteur do Irã , Abdolhossein Rouholamini Najafabadi, a maior unidade de produção de proteínas recombinantes (incluindo eritropoietina) no sudoeste da Ásia foi inaugurada na presença do presidente iraniano Mahmud Ahmadineschad . Nesta instalação, a empresa farmacêutica iraniana Pooyesh Darou Pharmaceuticals produz, entre outras coisas, a preparação de EPO PDpoetina .
- A empresa iraniana de biotecnologia Cinnagen produz a preparação EPO Erytrex (epoetina β) em cooperação com o fabricante de medicamentos Zahravi Pharmaceuticals .
- Na Indonésia, as empresas farmacêuticas Novell Pharmaceutical Laboratories e Kalbe Farma estão representadas com os produtos Epotrex e Hemapo, respectivamente.
- A maior empresa farmacêutica das Filipinas, a United Laboratories Inc. , vende, por meio de sua subsidiária Biomedis Inc. , a preparação Renogen .
EUA, América Central e América do Sul
- No Brasil, a farmacêutica Cristália desenvolveu um EPO genérico que está disponível sem receita médica em cooperação com o instituto de pesquisa semi-público Instituto Butantan . A farmacêutica Blausiegel também está representada no Brasil com os preparados Eritromax e AlfaEpoetina .
- Na Argentina (além da preparação Hemax , veja acima) as preparações Epoyet e Hypercrit são produzidas pela empresa farmacêutica Bio Sidus .
- Em Cuba, sob a liderança do Centro de Ingeniería Genética y Biotecnología estatal , foi desenvolvida uma variante genérica α em células CHO, que é vendida para o mercado interno pela farmacêutica Heber Biotec com sede em Havana com o nome comercial de Heberitro . O co-fornecedor local da Heber Biotec é a CIMAB SA com o produto EPOCIM .
- A empresa americana de serviços biofarmacêuticos Protein Sciences desenvolveu um processo para a produção de um biossimilar de EPO em células de inseto e oferece esse processo como licenciador. A EPO gerada em células de inseto que são transfectadas com baculovírus tem atividade biológica, segundo informações da empresa, que corresponde a cerca de duas vezes a da preparação padrão de EPO ( Epogen ).
- A AXXO GmbH , empresa sediada na empresa Hamburgo, adquiriu recentemente a empresa mexicana Nedder Farmaceuticos que como subsidiária sob a designação Axxo Mexico mudou de nome e produz, entre outras coisas, um EPO recombinante para o mercado latino-americano. Os concorrentes nacionais são as empresas farmacêuticas Probiomed com BIOYETIN ™, Pisa com EXETIN-A e Laboratorios Cryopharma com EPOMAX .
África e oriente médio
- Uma preparação de EPO sob o nome comercial Repotin (EPO α) é fabricada na África do Sul desde 1997 pela empresa Bioclones de Joanesburgo .
- Pelo menos quatro empresas no Egito fabricam preparações de EPO para o mercado nacional: EIPICO com Epoform , Amoun Pharmaceuticals com Erypoietin , Sedico com Epoetinv e T3A Pharma com Pronivel . Na Argentina, Pronivel é comercializado pela empresa farmacêutica Laboratorio Elea .
- A InSight Biopharmaceuticals é o único fabricante de EPO genérico a granel em Israel . A empresa Prospec TechnoGene também produz variantes α e β de EPO em células CHO, mas apenas para fins laboratoriais.
- A empresa farmacêutica Julphar (Gulf Pharmaceuticals Industries) com base no Emirado de Ra's al- Khaimah fabrica uma variante de EPO-α sob o nome comercial Epotin .
Europa
- Em junho de 2005, a empresa farmacêutica croata Pliva recebeu permissão da autoridade reguladora local responsável para comercializar um genérico EPO ( Epoetal ) na Croácia. Uma expansão dos direitos de distribuição para o mercado pan-europeu foi buscada em cooperação com a empresa australiana Mayne Pharma , mas de acordo com um comunicado de imprensa datado de 22 de fevereiro de 2006, ela foi descontinuada. A razão para esta decisão pode ser as violações massivas das diretrizes de boas práticas de fabricação na instalação de produção da Pliva em Zagreb que foram descobertas pelo FDA durante uma inspeção em janeiro / fevereiro de 2006 . Após o fracasso de uma aquisição pela fabricante de genéricos islandesa Actavis , a empresa farmacêutica norte-americana Barr Pharmaceuticals está tentando adquirir a Pliva desde junho de 2006 . Como resultado de um processo de aquisição que foi concluído em 18 de julho de 2008, a Barr Pharmaceuticals e, portanto, também a Pliva, pertencem à empresa farmacêutica israelense Teva Pharmaceutical Industries .
- Na Ucrânia, a empresa Biopharma produz uma preparação de EPO sob o nome de produto Epocrin (Епокрин) para os mercados doméstico e russo. O fabricante da variante Epocrin (Эпокрин) na Rússia é a empresa farmacêutica Sotex .
- Na Inglaterra, o fabricante de genéricos GeneMedix anunciou o lançamento no mercado de uma preparação EPO com o nome de produto Epostim em maio de 2005 . Nesse ínterim, a data alvo foi adiada para o terceiro trimestre de 2007. Em 31 de março de 2008, a GeneMedix anunciou que havia obtido a licença de fabricação do Epostim nas instalações de fabricação em Tullamore, Irlanda , e a aprovação para conduzir estudos clínicos na União Europeia. Nesse ínterim, a GeneMedix foi adquirida pela empresa indiana Reliance Industries .
- O conselho de administração da Stada Arzneimittel declarou em um comunicado à imprensa em 30 de março de 2006 que a apresentação dos documentos de aprovação à Agência Europeia de Medicamentos para a produção e venda de um genérico de EPO estava planejada no segundo trimestre de 2006 e que o mercado o lançamento aconteceria no final de 2006 ou o início de 2007 é esperado. Em 30 de junho de 2006, o STADA anunciou que a empresa havia apresentado os documentos de aprovação à Agência Europeia de Medicamentos para a produção de eritropoietina zeta no mesmo dia. O parceiro de cooperação para a produção do biossimilar para o estudo clínico é a empresa de biotecnologia Bibitec, sediada em Bielefeld . Em novembro de 2006, a empresa norte-americana Hospira adquiriu os direitos de distribuição da eritropoietina zeta para comercialização na Comunidade Europeia e no Canadá / EUA. Em 18 de outubro de 2007, STADA e Hospira receberam uma decisão positiva do Comitê de Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos para o lançamento no mercado dos produtos Silapo e Retacrit . STADA recebeu a notificação de aprovação final para o lançamento no mercado de ambas as preparações para o primeiro trimestre de 2008 em 19 de dezembro de 2007. Hospira , parte do grupo farmacêutico americano Pfizer desde 2015 , foi a primeira empresa a receber a aprovação do FDA para os EUA em maio 15, 2018 Market.
- A fabricante britânica de genéricos Therapeutic Proteins anunciou em um comunicado à imprensa em 12 de maio de 2006 que apresentaria documentos de aprovação à Agência Europeia de Medicamentos para a produção e venda de um genérico EPO sob o nome comercial TheraPoietin e para dois outros biossimilares. Todos os três biossimilares serão produzidos em cooperação com o fabricante britânico Angel Biotechnology .
- Em 2007, o fabricante genérico HEXAL foi o primeiro a receber a aprovação da Comissão da UE para um biossimilar de epoetina sob o nome comercial Epoetina alfa Hexal . A preparação também foi aprovada sob as marcas Binocrit ( Sandoz ) e Abseamed ( Medice ). Todas as três preparações são feitas pela empresa Rentschler Biotechnologie em Laupheim por meio de um contrato . Em janeiro de 2008, a Sandoz chegou a um acordo com a empresa de tecnologia médica Gambro para desenvolver uma estrutura de vendas conjunta para a preparação Binocrit na Alemanha.
- Em julho de 2009, o fabricante de genéricos Ratiopharm recebeu a recomendação de aprovação do Comitê de Medicina Humana (CHMP) da Agência Europeia de Medicamentos para um biossimilar de EPO que havia desenvolvido. A autorização final de introdução no mercado da preparação Eporatio (Epoetina θ), também vendida pela Berlin CT Arzneimittel com a marca comercial Biopoin , ocorreu em dezembro de 2009.
O caso "Eprex"
De 1998 em diante, houve efeitos colaterais graves ao usar o agente EPO Eprex / Erypo . Por iniciativa da autoridade competente, todos os componentes da proteína humana tiveram de ser removidos da formulação dos produtos farmacêuticos devido ao possível risco de contaminação do HIV ou do patógeno causador da doença de Creutzfeldt-Jakob . O fabricante Ortho Biotech então usou o estabilizador polissorbato 80 em vez de albumina de soro humano . Um estudo conduzido pela Johnson & Johnson descobriu que a adição de polissorbato causou fatalmente os plastificantes se dissolverem nas rolhas de borracha das seringas Epo. Essas reações imunológicas desencadearam uma eritroblastopenia ( Aplasia Pura de Células Vermelhas = PRCA ) em pelo menos 250 pacientes tratados com Erypo . Este incidente levantou a questão em todo o mundo até que ponto as sequências de aminoácidos alteradas, glicoestruturas alteradas ou impurezas na produção de proteínas terapêuticas e seus derivados (por exemplo, biossimilares) podem levar a tais efeitos colaterais. A autoridade reguladora brasileira Agência Nacional de Vigilância Sanitária (abreviatura: ANVISA) impôs uma proibição de importação de duas preparações de EPO no mesmo ano. Num estudo da Universidade de Utrecht sobre oito preparações vendidas fora da UE e dos EUA, foram constatadas deficiências graves em termos de eficácia, pureza e consistência da formulação. Esses resultados foram confirmados por um novo estudo com preparações da Coréia, China e Índia. No entanto, estudos recentes da Universidade de Utrecht sobre os epobiossimilares aprovados na Europa de acordo com as diretrizes europeias mostram que eles são de qualidade pelo menos equivalente às preparações originais.
Formas de dosagem
A forma galênica usual das preparações de EPO atualmente aprovada pelas autoridades competentes é a de uma solução injetável com diferentes concentrações da substância ativa (cerca de 500 a 30.000 UI ). Além da EPO, a solução à base de água para fins injetáveis também contém substâncias auxiliares (como ureia , polissorbato 20 , vários aminoácidos e sais de sódio) que servem para estabilizar a substância ativa. As soluções injetáveis são administradas por via subcutânea ou intravenosa . Dependendo da aplicação, concentração de princípio ativo, indicação e duração da ação ou meia-vida sérica da preparação, são necessárias várias injeções por semana ou apenas uma injeção por mês. O valor DDD das preparações de primeira geração é de 1000 UI, no caso das preparações Aranesp e Mircera é de 4,5 microgramas cada.
O trabalho está sendo realizado em formas alternativas de administração, particularmente em conexão com o desenvolvimento de novas drogas eritropoiéticas (por exemplo, administração intrapulmonar da preparação de EPO-Fc de Syntonix e administração intramuscular da preparação de Repoxygen de Oxford BioMedica , ver a próxima geração de EPO capítulo de preparações ). No caso das preparações padrão (por exemplo, Procrit da Johnson & Johnson ), as formulações de liberação sustentada foram investigadas, por exemplo, B. via o chamado encapsulamento em microesferas biodegradáveis . O principal objetivo era aumentar os intervalos entre as doses individuais e melhorar a tolerabilidade. Um problema sério com o encapsulamento é a formação de agregados de EPO, o que exclui o uso em pacientes. No final da década de 1990, a empresa americana Alkermes conseguiu contornar esse problema com sua tecnologia ProLease patenteada. No entanto, as microesferas são potenciais adjuvantes antigênicos que podem desencadear respostas imunológicas indesejáveis no paciente. Isso pode explicar porque os estudos clínicos dessas formulações não foram realizados até o momento. Uma equipe japonesa pode mostrar o contraste em ratos de que a incorporação de EPO em microesferas de gelatina - hidrogel pode ser usada com sucesso no tratamento de distúrbios circulatórios nas extremidades inferiores .
Também foram feitas pesquisas sobre as formas de administração oral em que era necessário superar o problema da desnaturação do ácido pelo suco gástrico . A empresa britânica Provalis (anteriormente Cortecs International ) trabalhou em formulações orais em cooperação com a Johnson & Johnson . No entanto, os resultados disso nunca foram publicados. Com a falência da Provalis em 2006, essas atividades foram paralisadas. A empresa americana Access Pharmaceuticals está trabalhando em uma nova abordagem para a administração oral de EPO . A rota de absorção natural da vitamina B 12 é usada. Ao revestir a EPO com o derivado da vitamina B 12 cianocobalamina , são criadas nanopartículas que, em conjunto com as haptocorrinas contidas na saliva e o fator intrínseco no estômago, formam um complexo que é protegido da destruição pelo ataque de ácido no estômago. na corrente sanguínea por meio de receptores no intestino delgado . O desenvolvimento de tal preparação ainda está nos estágios experimentais pré-clínicos.
A empresa australiana de nanotecnologia Nanotechnology Victoria está trabalhando em técnicas para a administração intrapulmonar de EPO . Para tanto, foi desenvolvido um dispositivo de inalação que, com base na onda acústica de superfície, possibilita a geração de gotículas nanoparticuladas de terapêutica de alto peso molecular.
A farmacêutica norte-americana Zosano afirma ter desenvolvido uma tecnologia de microinjeção que permite a administração transdérmica de proteínas terapêuticas. A aplicação desta técnica com EPO encontra-se atualmente em fase experimental pré-clínica.
Efeitos colaterais e contra-indicações
Uma vez que os receptores de EPO são formados na superfície de uma ampla variedade de células tumorais, existe fundamentalmente a possibilidade de que a administração de preparações de EPO possa estimular o crescimento de doenças malignas de todos os tipos. Dois ensaios clínicos controlados, nos quais pacientes com vários tipos de câncer, incluindo câncer de cabeça e pescoço e câncer de mama, foram tratados com EPO recombinante, mostraram um aumento inexplicável na mortalidade . Tem havido boa experiência com o tratamento da anemia do mieloma múltiplo , linfoma não Hodgkin e leucemia linfocítica crônica . Devido à natureza dos efeitos colaterais, é necessário cuidado especial em pacientes hipertensos . O abuso de pessoas saudáveis (por exemplo, para fins de doping) pode levar a um aumento excessivo no valor do hematócrito . Isto está associado ao risco de complicações do sistema cardiovascular com risco de vida ( risco de trombose devido à hemoconcentração na poliglobulia ).
Na primavera de 2007, o FDA dos EUA publicou um alerta sobre o uso de substâncias estimuladoras da eritropoiese como resultado dos resultados de quatro estudos clínicos nos quais regimes de tratamento não testados anteriormente tinham efeitos colaterais potencialmente fatais. Níveis de hemoglobina acima de 12 g / dL, ajustados nos pacientes afetados por meio de preparações de EPO, levaram a um aumento significativo da taxa de mortalidade. Por causa disso, o FDA ordenou a alteração das advertências anteriores nas bulas dos produtos Aranesp , Epogen e Procrit .
Em outro estudo multicêntrico sobre o uso de epoetina β na anemia em pacientes com câncer de mama submetidas à quimioterapia, no entanto, nenhum aumento na mortalidade pôde ser verificado. Neste estudo, a EPO foi administrada mesmo quando o nível de hemoglobina caiu abaixo de 12,9 g / dL. Obviamente, a mortalidade com a terapia com EPO não depende diretamente do nível de hemoglobina definido. Em vez disso, aumenta em pacientes com câncer quando não estão recebendo quimioterapia.
Uma meta-análise de 53 estudos clínicos com quase 14.000 pacientes chegou à conclusão em maio de 2009 que a mortalidade de pacientes com câncer após a administração de preparações de EPO é aumentada por um fator de 1,17 em comparação com aqueles que não foram submetidos a qualquer terapia de EPO. Em pacientes recebendo quimioterapia ao mesmo tempo, o fator foi 1,10.
O risco de pacientes com câncer com terapia com EPO não se limita à progressão do tumor que pode ser causada pela EPO. O risco de tromboembolismo venoso aumenta significativamente com a terapia com EPO em pacientes com tumores sólidos. A Sociedade Alemã de Hematologia e Oncologia, portanto, recomenda o uso de EPO na medicina do câncer apenas em pacientes adultos com anemia induzida por quimioterapia, se eles apresentarem sintomas. Além disso, o nível de hemoglobina deve ser aumentado até um máximo de 12 g / dl. A terapia deve ser interrompida assim que o valor de hemoglobina alvo de um máximo de 12 g / dl for atingido ou quatro semanas após o final da quimioterapia. Ao prescrever medicamentos com ingredientes ativos (AEEs) "formadores de sangue" (estimulantes da eritropoiese) para o tratamento da anemia sintomática no caso de insuficiência renal crônica, as instruções de terapia obrigatória se aplicam na Alemanha. A respectiva resolução do Federal Joint Committee (G-BA) de 23 de junho de 2011 entrou em vigor em 22 de setembro de 2011 após sua publicação no Diário Oficial da União.
Dados de mercado para suplementos de EPO
Como agente terapêutico, o EPO era um dos dez medicamentos de maior sucesso no mundo até 2004 e, entre os biofármacos, é um dos maiores sucessos de bilheteria . Nesse ínterim, os produtos EPO representaram mais de 30% das vendas de proteínas recombinantes terapêuticas. O Eprex / Procrit da Johnson & Johnson arrecadou $ 3,6 bilhões em 2004, o Epogen da Amgen $ 2,6 bilhões e o NeoRecormon da Roche $ 1,7 bilhão. Aranesp , o primeiro EPO aprovado de próxima geração, teve uma taxa média de crescimento de cerca de US $ 800 milhões anuais desde o seu início. Em 2006, as vendas da Amgen de Aranesp totalizaram 4,1 bilhões de dólares americanos, superando as vendas das preparações padrão anteriores pela primeira vez. O sucessor drogas DYNEPO e MIRCERA eram esperados para ter taxas de vendas iniciais de US $ 300 milhões e US $ 900 milhões, respectivamente. No entanto, esses prognósticos não foram confirmados. Em 2010 as vendas com a Mircera foram de 285 milhões de dólares americanos, a DynEpo foi retirada do mercado no final de 2008. Em 1999, cerca de 350.000 pacientes em todo o mundo receberam EPO recombinante. Como os números das vendas de preparações de EPO mais do que triplicaram entre 1999 e 2005, o número de pacientes tratados com EPO provavelmente aumentou proporcionalmente no período correspondente.
Em 2007, no decurso do lançamento no mercado dos primeiros produtos imitadores na União Europeia, o desenvolvimento de novos produtos EPO ( DynEpo , Mircera ) e o debate sobre a segurança da utilização de EPO no tratamento da anemia tumoral, os números das vendas para produtos padrão caiu pela primeira vez. Em 2007, foram faturadas US $ 11,8 bilhões com os preparados padrão, uma redução de US $ 100 milhões em relação a 2006. Em 2010, as vendas agora eram de apenas US $ 8,2 bilhões, até os níveis de 2002.
Em 2007, cerca de 470 milhões de dólares americanos foram vendidos na Alemanha com preparações de EPO. De acordo com dados oficialmente disponíveis, isso corresponde a cerca de 4,5% do resultado das vendas globais alcançado no mesmo período. A introdução de medicamentos genéricos na Alemanha provocou queda nos preços. Os biossimilares oferecem uma vantagem de preço significativa em relação ao preço fixo do produto de referência. Para reduzir os custos dos medicamentos na Alemanha, por exemplo, a Associação de Médicos de Seguro Saúde Estatutário de Berlim planejou aumentar a proporção de prescrições de biossimilares EPO para 50% em 2008. No início de 2009, a quota de mercado de biossimilares EPO era agora de 53%, enquanto a quota de preparações originais e suas reimportações caíam para 38% e 9%, respetivamente. Segundo estimativas, as seguradoras de saúde conseguiriam economizar cerca de oito bilhões de euros até 2020 com o uso de biossimilares. Na China, 14 diferentes preparações de EPO estão oficialmente representadas no mercado, com vendas totais em 2006 de cerca de 50 milhões de dólares americanos. Na Índia, as vendas de produtos EPO foram de US $ 22 milhões em 2006, com taxas de crescimento anual de 20-30% até então.
EPO doping
Quanto mais glóbulos vermelhos houver na corrente sangüínea humana , mais eficientemente o organismo inteiro funcionará, porque as células têm uma quantidade correspondentemente grande de oxigênio disponível. Por esse motivo, o EPO tem sido mal utilizado para melhorar o desempenho desde o final dos anos 1980. Atletas de resistência, em particular, se beneficiam do efeito; no entanto, o aumento da proporção de eritrócitos no sangue aumenta o risco de coágulos sanguíneos . EPO (e, posteriormente, todos os outros derivados, como darbepoetina) tem estado na lista de doping da organização internacional anti-doping (WADA) desde 1990 , por isso seu uso em esportes competitivos é proibida. Um método de detecção praticável para EPO não endógeno também tem sido usado em amostras de urina desde 2000 . No entanto, como o método de detecção só é eficaz nos primeiros quatro dias após a administração e o efeito significativo de melhoria do desempenho diminui continuamente, mas dura até 17 dias, os Jogos Olímpicos de 2000 também eram jogos de EPO.
Segundo cálculos do cientista esportivo italiano, Prof. Alessandro Donati, de 2007, 500.000 pessoas em todo o mundo estão se dopando com EPO. De acordo com a pesquisa de Donati, a quantidade de EPO produzida anualmente excede a necessidade terapêutica real em cinco a seis vezes.
Veja também
- Hematócrito (abreviatura: Hct, Hkt ou Hk), na medicina descreve a proporção de componentes celulares, principalmente glóbulos vermelhos (eritrócitos) , no volume do sangue e é uma medida da viscosidade do sangue. Os valores normais para homens estão entre 40 e 53 por cento.
- Na reação de sedimentação - abreviado BSR, BKS, sedimentação de sangue; também: velocidade de hemossedimentação (VHS), é um método de pesquisa simples e inespecífico de doenças inflamatórias. Os componentes celulares do sangue são comparados com o comprimento da coluna livre de células de plasma sanguíneo.
Nomes comerciais
- Epoetina alfa: Abseamed (D), Binocrit (D), Epoetina alfa HEXAL (D), Erypo (D)
- Epoetina beta: NeoRecormon (D)
- Epoetina zeta: Retacrit (D), Silapo (D)
- Epoetina teta: Biopoin (D), Eporatio (D)
literatura
Artigos de revisão
- Allan Jacob Erslev : Erythropoietin. In: New England Journal of Medicine. Volume 324, 1991, pp. 1339-1344.
Biossíntese e função biológica
- PC Watkins et al.: Atribuição regional do gene da eritropoietina à região do cromossomo humano 7pter-q22 . Em: Cytogenet Cell Genet , 1986, 42, pp. 214-218 PMID 2875851
- GL Wang, Semenza GL : Envolvimento geral do fator 1 indutível por hipóxia na resposta transcricional de hipóxia . Em: Proc Natl Acad Sci USA , 1993, 90, pp. 4304-4308. PMID 8387214
- SS Watowich: Ativação da sinalização da eritropoietina por dimerização do receptor . Em: Int J Biochem Cell Biol , 1999, 31, pp. 1075-1088. PMID 10498627
- TR Lappin et al.: Alter ego do EPO: a eritropoietina tem múltiplas ações . In: Stem Cells , 2002, 20, pp. 485-492. PMID 12456956
Propriedades estruturais
- MA Recny et al.: Caracterização estrutural da eritropoietina derivada de DNA recombinante urinária humana natural . Em: J Biol Chem , 1987, 262, pp. 17156-17163 PMID 3680293
- H Sasaki. et al .: Estrutura de carboidratos da eritropoietina expressa em células de ovário de hamster chinês por um cDNA de eritropoietina humana . Em: J Biol Chem , 1987, 262, pp. 12059-12076. PMID 3624248
- N Kawasaki. et al.: Análise estrutural de oligossacarídeos N-ligados sulfatados em eritropoietina . Em: Glycobiology , 2001, 11, pp. 1043-1049. PMID 11805077
- AW Gross, HF Lodish: Cellular traffic and degradation of erythropoietin and novel erythropoietin estimulating protein (NESP) . In: J Biol Chem , 2006, 281, pp. 2024-2032. PMID 16286456
História da pesquisa
- D. Jourdanet: De l'anemie des altitudes et de l'anemie en general dans ses reports avec la pression del l'atmosphere . Balliere, Paris 1863.
- P. Carnot, C. Deflandre: Sur l'activité hémopoiétique du sérum au cours de la régénération du sang . In: CR Acad Sei , 1906, 143, pp. 384-386; doi: 10.1161 / 01.RES.24.3.488 .
- C. Gibelli: Sobre o valor do soro dos animais anêmicos na regeneração do sangue . Em: Naunyn-Schmiedeberg's Archives of Pharmacology , 1911, 65, pp. 284-302 doi: 10.1007 / BF01841822 .
- G. Sandor: Sobre o efeito hematopoiético do soro de animais mantidos em ar diluído . In: Z. Whole Exp. Med. , 1932, 82, pp. 633-646.
- E. Bonsdorff, E. Jalavisto: Um mecanismo humoral na eritrocitose anóxica . Em: Acta Physiol Scand , 1948, 16, pp. 150-170; doi: 10.1111 / j.1748-1716.1948.tb00535.x .
- A. Erslev: regulação humoral da produção de glóbulos vermelhos . In: Blood , 1953, 8, pp. 349-357. PMID 13032205
- Maluf NS: História de transfusão de sangue . In: J Hist Med Allied Sei , 1954, 9, pp. 59-107. PMID 13118144
- LO Jacobson et al.: Papel do rim na eritropoiese . In: Nature , 1957, 179, pp. 633-634. PMID 13418752
- T. Miyake, CK Kung, E. Goldwasser: Purification of human erythropoietin . Em: J Biol Chem , 1977, 252, pp. 5558-5564. PMID 18467
- Lee-Huang S.: Cloning and expression of human erythropoietin cDNA in Escherichia coli . In: Proc. Nat. Acad. Sci. USA , 1984, 81, pp. 2708-2712. PMID 6371819
- FK Lin et al.: Cloning and expression of the human erythropoietin gene . Em: Proc Natl Acad Sci USA , 1985, 82, pp. 7580-7584. PMID 3865178
- K. Jacobs et al.: Isolamento e caracterização de clones genômicos e de cDNA de eritropoietina humana . In: Nature , 1985, 313, pp. 806-810. PMID 3838366
- Patente US4703008 : Sequências de DNA que codificam eritropoietina. Inventor: FK Lin.
- W. Jelkmann: Eritropoietina após um século de pesquisa: mais jovem do que nunca . In: Eur J Haematol , 2007, 78, pp. 183-205. PMID 17253966
Indicação para terapia com EPO
- RYD Fleming et al.: O efeito da eritropoietina em voluntários saudáveis normais e pacientes pediátricos com queimaduras. In: Cirurgia. Volume 112, 1992, pp. 424-432.
- S. Schreiber et al.: Eritropoietina recombinante para o tratamento da anemia na doença inflamatória do intestino . In: N Engl J Med , 1996, 334, pp. 619-623. PMID 8592524
- GD Demetri et al.: O benefício da qualidade de vida em pacientes quimioterápicos tratados com epoietina alfa é independente da resposta da doença ou do tipo de tumor: resultados de um estudo oncológico comunitário prospectivo . Em: J Clin Oncol , 1998, 10, pp. 3412-3425. PMID 9779721
- K. Nishii et al.: Tratamento bem sucedido da anemia aplástica com G-CSF e eritropoietina em altas doses . Em: Leuk Lymphoma , 1998, 30, pp. 211-214. PMID 9669693
- DH Henry: Experiência com epoetina alfa e anemia da síndrome da imunodeficiência adquirida . In: Semin Oncol , 1998, 25, pp. 64-68. PMID 9671334
- FR Dunphry et al.: A eritropoietina reduz a anemia e as transfusões: um ensaio randomizado com ou sem eritropoietina durante a quimioterapia . In: Cancer , 1999, 86, pp. 1362-1367. PMID 10506726
- H. Feldmann et al.: Fluxo sanguíneo e status de oxigenação de tumores humanos. Investigações clínicas . In: Strahlenther Onkol , 1999, 175, pp. 1-6. PMID 9951511
- C. Gasche et al.: Tratamento sequencial da anemia na colite ulcerosa com ferro intravenoso e eritropoietina . In: Digestion , 1999, 60, pp. 262-267. PMID 10343140
- M. Cazzola: Fatores de crescimento hematopoiético no tratamento de síndromes mielodisplásicas . In: Forum (Genova) , 1999, 9, pp. 49-57. PMID 10101210
- M. Milano, R. Collomp: eritropoietina e neuroproteção: uma perspectiva terapêutica . In: J Oncol Pharm Pract , 2005, 11, pp. 145-149. PMID 16595066
- H. Ehrenreich et al.: Melhoria das funções cognitivas em pacientes esquizofrênicos crônicos por eritropoietina humana recombinante . In: Mol Psychiatry , 2007, 12 (2), pp. 206-220. PMID 17033631
- M. Krebs et al.: Agentes neuroprotetores na esquizofrenia e transtornos afetivos . Em: Expert Opin Pharmacother , 2006, 7, pp. 837-848. PMID 16634707
Compostos de EPO de primeira geração
- L. Ehrlich: Uso de EPOGEN para tratamento de anemia associada a insuficiência renal crônica . Em: Crit Care Nurs Clin North , 1990, Am 2, pp. 101-113. PMID 2357306
- Patente US5441868 : Produção de eritropoietina recombinante. Inventor: FK Lin.
- PL Storring et al.: Epoetina alfa e beta diferem em sua composição de isoformas de eritropoietina e propriedades biológicas . In: Br J Haematol , 1998, 100, pp. 79-89. PMID 9450795
- V. Skibeli et al.: O perfil do açúcar prova que a eritropoietina sérica humana difere da eritropoietina humana recombinante . In: Blood , 2001, 98, pp. 3626-3634. PMID 11739166
- A. Bren et al.: Uma comparação entre epoetina ômega e epoetina alfa na correção de anemia em pacientes em hemodiálise: um estudo cruzado prospectivo e controlado . In: Artif Organs , 2002, 26, pp. 91-97. PMID 11879235
- R. Deicher, WH Horl: Diferenciando fatores entre agentes estimuladores da eritropoiese: um guia para a seleção para anemia de doença renal crônica . In: Drugs , 2004, 64, pp. 499-509. PMID 14977387
- J. Glaspy, Y. Beguin: estratégias de gerenciamento de anemia: otimizando o tratamento usando epoetina beta (NeoRecormon) . In: Oncology , 2005, 69 Suppl. 2, pp. 8-16. PMID 16244505
- T. Littlewood: Epoetina alfa (Eprex) e qualidade de vida . In: Curr Med Res Opin. , 2005, 21 Suplemento 2: S1-S2. PMID 15969857
Compostos de EPO de próxima geração
- FC Wrighton et al.: Pequenos peptídeos como miméticos potentes do hormônio protéico eritropoietina . In: Science , 1996, 273, pp. 458-464. PMID 8662529
- A. Battaglia et al.: A proteína de fusão MEN 11303 (fator estimulador de colônia de granolócitos-macrófagos / eritropoietina) atua como um potente indutor de eritropoiese . In: Exp Hematol , 2000, 28, pp. 490-498. PMID 10812238
- JQ Hudson, RM Sameri: Darbepoetina alfa, uma nova terapia para o tratamento da anemia da doença renal crônica . In: Pharmacotherapy , 2002, 22, pp. 141S-149S. PMID 12222584
- GG Kochendoerfer et al.: Projeto e síntese química da proteína da eritropoiese modificada com polímero homogêneo . In: Science , 2003, 299, pp. 884-887. PMID 12574628
- AJ Bitonti et al.: Entrega de uma proteína de fusão eritropoietina-Fc por inalação em humanos através de uma via de transporte de imunoglobulina . Em: J Aerosol Med , 2004, 18, pp. 294-303. PMID 16181004
- IC Macdougall: CERA (Continuous Erythropoietin Receptor Activator): um novo agente estimulador da eritropoiese para o tratamento da anemia . In: Curr Hematol Rep , 2005, 4, pp. 436-440. PMID 16232379
- SY Chen et al.: Proteínas eritropoiéticas sintéticas: ajuste do desempenho biológico por ligação de polímero específico do local . In: Chem Biol , 2005, 12, pp. 371-383. PMID 15797221
- F. Fiordaliso et al. (2005), A nonerythropoietic derivative of erythropoietin protege o miocárdio da lesão de isquemia-reperfusão Proc Natl Acad Sci, 102, pp. 2046-2051. PMID 15671158
- SR Hamilton et al.: Humanização de levedura para produzir glicoproteínas sialiladas terminais complexas . In: Science , 2006, 313, pp. 1441-1443. PMID 16960007
- Österborg AC et al.: Um novo agente estimulador da eritropoiese (AMG114) com meia-vida de 131 horas trata efetivamente a anemia induzida por quimioterapia quando administrado como 200 mcg a cada 3 semanas . In: J Clin Oncol , 2006, 24, No. 18S, p. 8626. PMID 16982323
- Q. Fan et al.: Avaliação pré - clínica de Hematide, um novo agente estimulador da eritropoiese, para o tratamento da anemia . In: Exp Hematol , 2006, 34, pp. 1303-1311. PMID 16982323
- TR Coleman et al.: Doses citoprotetoras de eritropoietina ou eritropoietina carbamilada têm atividades pró-coagulante e vasoativas marcadamente diferentes . Em: Proc Natl Acad Sci USA , 2006, 103, pp. 5965-5970. PMID 16585502
Medicamentos imitadores (biossimilares) / O caso "Eprex"
- S. Louët: Lições de Eprex para empresas biogenéricas . Em: Nature Biotechnology , 2003, 21 (9), pp. 956-957. PMID 12949539
- H. Schellekens: Epoetinas biossimilares: quão semelhantes são? Em: EJHP Practice , 2004, 3, pp. 243–247. PMID 16006274
- K. Boven et al.: O aumento da incidência de aplasia pura de glóbulos vermelhos com uma formulação Eprex em seringas com tampa de borracha não revestidas . In: Kidney International , 2005, 67, pp. 2346-2353. PMID 15882278
- SK Niazi: Handbook of Biogeneric Therapeutic Proteins . 1ª edição. CRC Press, 2005, ISBN 0-8493-2991-4
- V. Zylka-Menhorn, ME Tippmann: Biofármacos são “inimitáveis” . In: Deutsches Ärzteblatt , 2006, Volume 103, Edição 6: A311-A314.
Formas de dosagem
- KF Pistel et al.: Microesferas carregadas com eritropoietina humana recombinante biodegradável preparadas a partir de copolímeros em bloco lineares e ramificados em estrela: (...) . In: J Control Release , 1999, 59, pp. 309-325. PMID 10332063
- Patente US5674534 : Composição para liberação sustentada de eritropoietina não agregada. Inventor: SE Zale.
EPO doping
- J. Scott, GC Phillips: Erythropoietin in sports: a new look on a old problem . In: Curr Sports Med Rep , 2005, 4, pp. 224-226. PMID 16004833
- Diamanti-Kandarakis E. et al.: Abuso de eritropoietina e dopagem do gene da eritropoietina: estratégias de detecção na era genômica . In: Sports Medicine , 2005, 35, pp. 831-840. PMID 16180943
- W. Jelkmann: Novos agentes eritropoiéticos: uma ameaça ao espírito esportivo . (PDF) In: Medicina Sportiva , 2007, 11, pp. 32-42.
- K. Sharpe et al.: Uma abordagem de terceira geração para detectar o abuso de eritropoietina em atletas . In: Haematologica , 2006, 91, pp. 356-363. PMID 16503554
Procedimento de verificação
- F. Lasne, J. de Ceaurriz: Recombinant erythropoietin in urine . In: Nature , 2000, 405, p. 635. PMID 10864311
- F. Lasne: Double-blotting: uma solução para o problema da ligação inespecífica de anticorpos secundários em procedimentos de immunoblotting . Em: J Immunol Methods , 2003, 276, pp. 223-226. PMID 12738375
- M. Beullens et al.: Detecção de falso-positivo de eritropoietina humana recombinante na urina após exercício físico rigoroso . In: Blood , 2006, 107, pp. 4711-4713. PMID 16493001
- F. Lasne: Nenhuma dúvida sobre a validade do teste de urina para detecção de eritropoietina humana recombinante . In: Blood , 2006, 108, pp. 1778-1779. PMID 16926299
- W. Jelkmann: Agentes e técnicas estimulantes da eritropoiese: um desafio para analistas de doping . In: Curr Med Chem , 2009, 16 (10), pp. 1236-1247. PMID 19355882
- W. Jelkmann, C Lundby: Blood doping and its detecção . In: Blood , 2011, 118 (9), pp. 2395-404. doi: 10.1182 / blood-2011-02-303271 , PMID 21652677 .
Links da web
- EPO doping em ciclismo em cycling4fans.de
- EPO - Riscos e efeitos colaterais ; Oferta de informação independente da Agência Nacional Antidopagem (NADA)
- Relatório de Avaliação Público (EPAR) da Agência Europeia de Medicamentos (EMA) sobre: Epoetina
Evidência individual
- ↑ Ulrich Kuhlmann, Joachim Böhler, Friedrich C. Luft, Mark Dominik Alscher, Ulrich Kunzendorf: Nefrologia - Fisiopatologia - Clínica - Procedimento de substituição renal . Thieme Verlag, Stuttgart 2015, ISBN 978-3-13-700206-2 , p. 409
- ↑ E. Bodó et al.: Os folículos capilares humanos são uma fonte extrarrenal e um alvo não hematopoiético da eritropoetina . Em: FASEB J . , 2007, 21, pp. 3346-3354. PMID 17540710 .
- ^ RN Foley: Eritropoietina: Fisiologia e mecanismos moleculares . In: Heart Fail Rev., 2008, 13, pp. 405-414. PMID 18236154 .
- ↑ B. Adamcio et al.: A eritropoietina aumenta a potenciação e a memória de longo prazo do hipocampo . In: BMC Biol. , 9 de setembro de 2008, 6 (1), página 37. PMID 18782446 .
- ↑ D. Burger, F. Xiang, L. Hammoud, X. Lu, Q. Feng: Role of heme oxygenase-1 nos efeitos cardioprotetores da eritropoietina durante a isquemia miocárdica e reperfusão. In: Am. J. Physiol. Heart Circ. Physiol. 296, 2009, pp. H84-H93 PMID 18996987 .
- ↑ UniProt P01588
- ↑ B. Agoram, K. Aoki, S. Doshi, C. Gegg, G. Jang, G. Molineux, L. Narhi, S. Elliott: Investigação dos efeitos da atividade de ligação do receptor alterada na depuração de proteínas estimuladoras da eritropoiese : As vias não mediadas por receptores de eritropoietina podem desempenhar um papel importante. In: J Pharm Sci 98, 2009, pp. 2198-2211 PMID 18837016 .
- ↑ LO Narhi et al.: O efeito dos carboidratos na estrutura e estabilidade da eritropoietina . Em: J. Biol. Chem. , 1991, 266, pp. 23022-23026 PMID 1744097 .
- ↑ M. Brines et al.: Peptídeos protetores de tecido não eritropoiéticos derivados da estrutura terciária da eritropoietina . In: Proc. Natl. Acad. Sci. USA , 2008, 105, pp. 10925-10930. PMID 18676614 .
- ↑ Fu-Kuen Lin: sequências de DNA que codificam a eritropoietina. Patente U.S. 4.703.008 (1985).
- ↑ S. Lee-Huang: Clonagem e expressão do cDNA da eritropoietina humana em Escherichia coli . Em: Proc Natl Acad Sci USA , 1984, 81, pp. 2708-2712. PMID 6371819 .
- ↑ K. Jacobs et al.: Isolamento e caracterização de clones genômicos e de cDNA de eritropoietina humana . In: Nature , 1985, 313, pp. 806-810. PMID 3838366 .
- ↑ E. Lacson, J. Rogus, M. Teng, JM Lazarus, RM Hakim: A associação da raça com a dose de eritropoietina em pacientes em hemodiálise de longo prazo. In: Am. J. Kidney Dis. 52, 2008, pp. 1104-1114 PMID 18824287 .
- ^ WC Winkelmayer, J. Liu, MA Brookhart: Altitude e mortalidade por todas as causas em pacientes incidentes da diálise. In: JAMA 301, 2009, pp. 508-512 PMID 19190315 .
- ^ M. Gallieni: Ferro no tratamento da anemia em pacientes de diálise: um suporte importante à eritropoietina. Em: Int J Artif Organs 21, 1998, pp. 681-686 PMID 9894741 .
- ↑ G. Amendola, R. Di Concilio, G. D'Urzo, P. Danise, G. Parisi, F. della Ragione, F. Rossi, B. Nobili, S. Perrotta: O tratamento com eritropoietina pode prevenir a transfusão de sangue na picnocitose infantil . Em: Br. J. Haematol. , 2008 143, pp. 593-595 PMID 18783402 .
- ↑ H. Ehrenreich, K. Weissenborn, H. Prange, D. Schneider, C. Weimar, K. Wartenberg, PD Schellinger, M. Bohn, H. Becker, M. Wegrzyn, P. Jähnig, M. Herrmann, M. Knauth, M. Bähr, W. Heide, A. Wagner, S. Schwab, H. Reichmann, G. Schwendemann, R. Dengler, A. Kastrup, C. Bartels: Recombinant human erythropoietin no tratamento de acidente vascular cerebral isquêmico agudo . In: Stroke , 40, 2009, pp. E647 - e656 PMID 19834012 .
- ↑ H. Ehrenreich et al.: Explorando a eritropoietina humana recombinante na esclerose múltipla progressiva crônica . In: Brain , 2007 ,; 130 (Pt 10), pp. 2577-2588. PMID 17728357 .
- ↑ S. Boesch, B. Sturm, S. Hering, H. Goldenberg, W. Poewe, B. Scheiber-Mojdehkar: ataxia de Friedreich: ensaio clínico piloto com eritropoietina humana recombinante . In: Ann. Neurol. , 2007, 62, pp. 521-524; PMID 17702040 .
- ↑ JF Grunfeld et al.: A eritropoietina atrasa o início da doença em um modelo de esclerose lateral amiotrófica . Em: Experimental Neurology , 2007, 204, pp. 260-263 PMID 17174305 .
- ↑ MG Lykissas et al.: Regeneração axonal estimulada pela eritropoietina: Um estudo experimental em ratos . Em: J Neurosci Methods , 2007, 164, pp. 107-115. PMID 17532473 .
- ↑ H. Ehrenreich et al.: Melhoria das funções cognitivas em pacientes esquizofrênicos crônicos por eritropoietina humana recombinante . In: Mol Psychiatry , 2006, 12, pp. 206-220; PMID 17033631 .
- ↑ K. Miskowiak, B. Inkster, S. Selvaraj, R. Wise, GM Goodwin, CJ Harmer: A eritropoietina melhora o humor e modula o processamento cognitivo e neural da emoção 3 dias após a administração . Em: Neuropsychopharmacology , 33, 2008, pp. 611-618 PMID 17473836 .
- ↑ M. Joyeux-Faure: Proteção celular pela eritropoietina: novas implicações terapêuticas? In: J. Pharmacol. Exp. Ther. 323, 2007, pp. 759-762; PMID 17717190 (revisão).
- ↑ MA Bogoyevitch: Uma atualização sobre os efeitos cardíacos da cardioproteção da eritropoietina pela eritropoietina e as lições aprendidas com estudos em neuroproteção . In: Cardiovasc. Res , 2004, 63, pp. 208-216. PMID 15249178 .
- ↑ D. Mihov et al.: A eritropoietina protege da lesão miocárdica induzida por reperfusão ao aumentar a produção de óxido nítrico endotelial coronário . In: Eur J Cardiothorac Surg. , 2009, 35 (5), pp. 839-846. PMID 19237290 .
- ↑ O EPO não ajuda as vítimas de ataque cardíaco em estudo .
- ↑ Darbepoetina alfa sem benefícios na insuficiência cardíaca . In: Deutsches Ärzteblatt , 18 de janeiro de 2013; Recuperado em 19 de janeiro de 2013.
- ^ H. Sorg, C. Krueger, T. Schulz, MD Menger, F. Schmitz, B. Vollmar: Os efeitos da eritropoietina na cura de feridas de pele são relacionados com a dose. In: FASEB J. , 2009, 23, pp. 3049-3058 PMID 19403513 .
- ↑ EPO na terapia de feridas: MHH testa um conceito inovador de cura sem efeitos colaterais . Hannover Medical School (MHH), comunicado à imprensa, 24 de março de 2010.
- ^ Achim-Peter Neubauer, Wolfgang Voss, Michael Wachtendorf, Tanja Jungmann: A eritropoietina melhora o resultado do neurodesenvolvimento de bebês extremamente prematuros . In: Annals of Neurology . fita 67 , nº 5 , maio de 2010, p. 657-666 , doi : 10.1002 / ana.21977 .
- ↑ Estudo em Göttingen: Doping contra Covid-19. In: mdr.de . Recuperado em 7 de julho de 2020 .
- ↑ Nomes não proprietários internacionais (DCI) para substâncias biológicas e biotecnológicas (PDF; 179 KB).
- ^ W. Jelkmann: Eficácia das eritropoietinas recombinantes: há unidade de unidades internacionais? In: Transplante de dial de nefrol . , 2009, 24, pp. 1366-1368. PMID 19225013 .
- ^ PM Cotes, DR Bangham: A preparação de referência internacional da eritropoietina . Em: Bull World Health Organ , 1966, 35, pp. 751-760. PMID 5297809 .
- ↑ L. Annable et al.: A segunda preparação de referência internacional de eritropoietina, humana, urinária, para bioensaio . Em: Bull World Health Organ , 1972, 47, pp. 99-112. PMID 4538911 .
- ↑ PL Storring et al.: O padrão internacional para eritropoietina derivada de DNA recombinante: estudo colaborativo de quatro eritropoietinas derivadas de DNA recombinante e duas eritropoietinas urinárias humanas altamente purificadas . In: J Endocrinol. , 1992, 134, pp. 459-484. PMID 1402553 .
- ^ ME Behr-Gross: Estudo colaborativo para o estabelecimento de eritropoietina BRP lote 3 . In: Pharmeuropa Bio. , 2007 (1), pp. 49-66. PMID 18413137 .
- ↑ Sentindo falta do boom biogenérico de $ 20 bilhões . CNNMoney.com, 15 de agosto de 2006
- ↑ Kirin, Sankyo encerrará a comercialização conjunta do medicamento para anemia renal ESPO (...) até o próximo mês de março . ( Memento de 28 de setembro de 2007 no Internet Archive ).
- ^ IC Macdougall: Novos agentes estimuladores da eritropoiese: uma nova era no controle da anemia . Em: Clin J Am Soc Nephrol. , 2008, 3 (1), pp. 200-207. PMID 18077782 .
- ↑ CERA: interação diferente com o receptor da eritropoietina e da epoetina .
- ^ Relatório de avaliação público europeu para Mircera .
- ^ Informações do especialista Mircera (PDF) junho de 2006.
- ↑ Cepo em vez de Epo . FAZ.net, 8 de julho de 2004.
- ^ F. Fiordaliso et al.: Um derivado não eritropoiético da eritropoietina protege o miocárdio da lesão de isquemia e reperfusão . Em: Proc Natl Acad Sei , 2005, 102, pp. 2046-2051. PMID 15671158 .
- ↑ F. Fahres et al.: Desenvolvimento de uma eritropoietina de ação prolongada pela fusão do peptídeo carboxi-terminal da subunidade beta da gonadotrofina coriônica humana à sequência de codificação da eritropoietina humana . In: Endocrinology , 2007, 148, pp. 5081-5087; PMID 17641000 .
- ↑ Aquisição da Shire Pharmaceuticals em 21 de abril de 2005 ( Memento de 31 de julho de 2012 no arquivo web archive.today ).
- ↑ Novo tratamento um sucesso para anemia associada à doença renal crônica ( Memento de 28 de setembro de 2007 no Arquivo da Internet ; PDF).
- ↑ Novo tratamento para anemia renal produzida por células humanas ... ( Memento de 27 de setembro de 2007 no Arquivo da Internet ) Comunicado de imprensa, 15 de março de 2007.
- ↑ Relatório trimestral da Shire e anúncio do CEO Angus Russel de 31 de julho de 2008 ( Memento de 5 de janeiro de 2011 no Internet Archive ).
- ↑ D. Kodama, D. Nishimiya, K. Iwata, K. Yamaguchi, K. Yoshida, Y. Kawabe, M. Motono, H. Watanabe, T. Yamashita, K. Nishijima, M. Kamihira, S. Iijima: Produção de eritropoietina humana por galinhas quiméricas. In: Biochem. Biophys. Res. Commun. 367, 2008, pp. 834-839 PMID 18201556 .
- ^ A Roche licencia a proteína de eritropoiese sintética da Gryphon Sciences . ( Memento de 20 de março de 2006 no Internet Archive ).
- ↑ Affymax e Takeda anunciam um recall nacional voluntário de todos os lotes de injeção de OMONTYS® (peginesatida) ( Memento de 18 de abril de 2015 no Internet Archive ), notificação na página inicial da Affymax Inc. de 23 de fevereiro de 2013 (acessada em 27 de fevereiro de 2013 )
- ↑ pôsteres da ProMetic Life Sciences Inc. para a preparação do PBI-1402 .
- ↑ Baesweiler: Biotech: Aplagen em processos de insolvência. In: aachener-nachrichten.de. 8 de abril de 2010, acessado em 2 de novembro de 2018 .
- ↑ Z. Liu, VS Stoll, PJ Devries, CG Jakob, N. Xie, RL Simmer, SE Lacy, DA Egan, JE Harlan, RR Lesniewski, EB Reilly: Um potente anticorpo humano que imita eritropoietina interage através de um novo local de ligação. In: Blood 110, 2007, pp. 2408-2413 PMID 17620453 .
- ↑ SA Qureshi et al.: Mimetismo de eritropoietina por uma molécula não peptídica . Em: Proc Natl Acad Sci USA , 1999, 96, pp. 12156-12161. PMID 10518592 .
- ↑ E. Bouman-Thio et al.: Um estudo de fase I, único e fracionado, de dose ascendente avaliando a segurança, farmacocinética, farmacodinâmica e imunogenicidade de uma proteína de fusão de anticorpo mimético de eritropoietina (CNTO 528) em indivíduos saudáveis do sexo masculino . Em: J Clin Pharmacol. , 2008, 48 (10), pp. 1197-1207. PMID 18812609 .
- ↑ Temos Repoxygen no compartimento do refrigerador . In: FAZ , 31 de janeiro de 2006.
- ↑ O "Biopump" da Medgenics.
- ↑ S. Akagi et al.: O papel crítico do domínio de homologia SRC 2 contendo tirosina fosfatase-1 na anemia hiporresponsiva à eritropoietina humana recombinante em pacientes em hemodiálise crônica . In: J Am Soc Nephrol. , 2004, 15, pp. 3215-3224. PMID 15579525 .
- ↑ A. Rinna, HJ Forman: A inibição de SHP-1 por 4-hidroxinonenal ativa a quinase N-terminal de Jun e a ligase de cisteína glutamato . Em: Am J Respir Cell Mol Biol. , 2008, 39, pp. 97-104. PMID 18276794 .
- ↑ Astellas adquire os direitos de FG-2216 e FG-4592 (...) para a Europa e outras regiões (...) ( Memento de 7 de agosto de 2008 no Arquivo da Internet ) Comunicado à imprensa, 28 de abril de 2006.
- ↑ Akebia anuncia o início da Fase 1 do estudo clínico do AKB-6548, comunicado à imprensa de 15 de setembro de 2009.
- ↑ CrystalGenomics entrou no desenvolvimento de terapias de hipóxia oral . ( Memento de 8 de outubro de 2007 no Internet Archive ) Comunicado de imprensa, 19 de setembro de 2006.
- ↑ Y. Nakano et al.: A administração oral de K-11706 inibe a atividade de ligação de GATA, aumenta a atividade de ligação do fator 1 induzível por hipóxia e restaura indicadores em um modelo de camundongo in vivo de anemia de doença crônica . In: Blood , 2004, 104, pp. 4300-4307 PMID 15328158 .
- ↑ A. Angelillo-Scherrer, L. Burnier, D. Lambrechts, RJ Fish, M. Tjwa, S. Plaisance, R. Sugamele, M. DeMol, E. Martinez-Soria, PH Maxwell, G. Lemke, SP Goff, GK Matsushima, HS Earp, M. Chanson, D. Collen, S. Izui, M. Schapira, EM Conway, P. Carmeliet: Role of Gas6 in erythropoiesis and anemia in mice. In: J. Clin. Investir. 118, 2008, pp. 583-596 PMID 18188450 PMC 217618 (texto completo gratuito).
- ↑ Diretrizes para produtos médico-biológicos semelhantes ( Memento de 21 de setembro de 2008 no Arquivo da Internet ) (PDF; 105 KB).
- ↑ Diretrizes para produtos médico-biológicos semelhantes que contêm eritropoietina recombinante ( Memento de 18 de julho de 2006 no Arquivo da Internet ).
- ↑ PlasmaSelect ( Memento de 22 de fevereiro de 2014 no Internet Archive ).
- ↑ Maior planta farmacêutica será inaugurada em breve . ( Memento de 17 de fevereiro de 2007 no Internet Archive ).
- ↑ EPO recombinante genérico da Cristália / Blausigel ( Memento de 4 de março de 2005 no Internet Archive ).
- ↑ Comunicado de imprensa da Pliva de 22 de fevereiro de 2006 ( Memento de 15 de dezembro de 2007 no Internet Archive ).
- ↑ Nicholas Buhay: CARTA DE AVISO 320-06-02. Public Health Service, Food and Drug Administration, 28 de abril de 2006, acessado em 10 de julho de 2009 .
- ↑ Comunicado de imprensa do Stada de 30 de março de 2006 ( Memento de 24 de maio de 2006 no Internet Archive ).
- ↑ Documentos de registro para biossimilar de eritropoietina enviados à EMEA . ( Memento de 12 de abril de 2013 no arquivo web archive.today ) STADA.
- ↑ Bibitec conclui o primeiro desenvolvimento de medicamento para um biossimilar . ( Memento de 4 de outubro de 2009 no Internet Archive ) NewLab BioQuality AG, comunicado à imprensa.
- ↑ STADA reorganiza projetos de biossimilares - direitos de distribuição da Epo-zeta para a Hospira . ( Memento de 12 de abril de 2013 no arquivo do arquivo da web. Hoje ) Comunicado de imprensa, 20 de novembro de 2006.
- ^ Comitê de Medicamentos para Uso Humano Resumo da opinião positiva para Silapo .
- ↑ STADA recebe aprovação para eritropoietina-zeta - introdução no 1º trimestre de 2008 ( Memento de 17 de julho de 2011 no Arquivo da Internet ) (PDF; 39 KB).
- ↑ Seth E. Cockrum: FDA aprova Retacrit como um biossimilar para Epogen®. Anúncio em lexicology.com datado de 15 de maio de 2018 (acessado em 15 de maio de 2018).
- ↑ Comunicado de imprensa da Therapeutic Proteins de 12 de maio de 2006 ( Memento de 4 de outubro de 2009 no Internet Archive ).
- ↑ Relatório de avaliação público (EPAR) da Agência Europeia de Medicamentos (EMA) sobre: Binocrit .
- ↑ Relatório de Avaliação Público (EPAR) da Agência Europeia de Medicamentos (EMA) para: Epoetin Alfa Hexal .
- ↑ Relatório de Avaliação Público (EPAR) da Agência Europeia de Medicamentos (EMA) sobre: Abseamed .
- ↑ Brevemente informado , Dtsch Arztebl 2010; 107 (17)
- ↑ SS Park, J. Park, J. Ko, L. Chen, D. Meriage, J. Crouse-Zeineddini, W. Wong, BA Kerwin: Biochemical assessment of erythropoietin products from Asia versus US Epoetin alfa fabricado por Amgen. In: J Pharm Sci 98, 2009, pp. 1688-1699 PMID 18781649 .
- ↑ Os EPOs biossimilares apresentam a mesma ou melhor qualidade . Iniciativa de Genéricos e Biossimilares, 12 de novembro de 2010
- ↑ KFPistel et al.: Microesferas carregadas com eritropoietina humana recombinante biodegradável preparadas a partir de copolímeros em bloco lineares e ramificados em estrela: (...) . In: J Control Release , 1999, 59, pp. 309-325. PMID 10332063 .
- ↑ SE Zale: Composição para liberação sustentada de eritropoietina não agregada , Patente US 5.674.534 (1999).
- ↑ L. Longhu et al.: A liberação sustentada de eritropoietina usando microesferas de hidrogel de gelatina biodegradável melhora persistentemente a isquemia da perna . In: J Am Coll Cardiol , 2009, 53, pp. 2378-2388.
- ↑ “NanoVentures Australia alcança um marco importante no desenvolvimento da tecnologia de entrega de medicamentos pulmonares” ( Memento de 21 de julho de 2012 no arquivo do arquivo da web. Hoje ) de 31 de maio de 2009.
- ↑ M. Henke et al.: Eritropoietina para tratar pacientes com câncer de cabeça e pescoço com anemia submetidos à radioterapia: ensaio randomizado, duplo-cego, controlado por placebo . In: The Lancet , 2003, 362, pp. 1255-1260. PMID 14575968 .
- ↑ B. Leyland-Jones et al.: Manutenção dos níveis normais de hemoglobina com epoetina alfa em pacientes principalmente não anêmicos com câncer de mama metastático recebendo quimioterapia de primeira linha: um estudo de sobrevivência . Em: Journal of Clinical Oncology , 2005, 23, pp. 5960-5972. PMID 16087945 .
- ↑ R. Baz et al.: A eritropoietina humana recombinante está associada ao aumento da sobrevida global em pacientes com mieloma múltiplo . In: Acta Haematologica , 2007, 117, pp. 162-167. PMID 17148935 .
- ^ JF San Miguel, R. García-Sanz: Eritropoietina humana recombinante na anemia de mieloma múltiplo e linfoma não-Hodgkin . Em: Medical Oncology , 1998, 15, Suppl 1, pp. S29-S34. PMID 9785334 .
- ↑ JR Wright et al.: Ensaio randomizado, duplo-cego, controlado por placebo de eritropoietina em câncer de pulmão de células não pequenas com anemia relacionada à doença . In: Journal of Clinical Oncology , 2007, 25, pp. 1027-1032. PMID 17312332 .
- ↑ Comentários da Amgen sobre o estudo de fase 3 em pacientes com câncer com anemia não decorrente de quimioterapia concomitante . ( Memento de 16 de maio de 2008 no Internet Archive ; PDF).
- ↑ Estudo da importância da Nova Proteína Estimulante da Eritropoiese (Aranesp®) para o efeito da radioterapia em pacientes com carcinoma espinocelular primário de cabeça e pescoço .
- ^ Roche para a inscrição no estudo da droga biológica Cera devido a questões de segurança . ( Memento de 7 de julho de 2007 no Internet Archive ).
- ↑ Alerta da FDA sobre agentes estimuladores da eritropoiese (ESA). ( Memento de 13 de novembro de 2007 no Internet Archive ; PDF).
- ↑ M. Aapro et al.: Efeito da epoetina beta uma vez por semana na sobrevida em pacientes com câncer de mama metastático recebendo quimioterapia à base de antraciclina e / ou taxano: resultados do estudo Anemia do câncer de mama e o valor da eritropoietina (BRAVE) . In: Journal of Clinical Oncology , 2008, 26, pp. 592-598. PMID 18235117 .
- ↑ Sina Vogt: efeito colateral risco de morte: medicamento para formação de sangue na crítica. Hospital da Universidade de Colônia, comunicado à imprensa de 11 de maio de 2009 em Informationsdienst Wissenschaft (idw-online.de), acessado em 15 de setembro de 2015.
- ↑ J. Bohlius et al.: Agentes estimuladores da eritropoiese humana recombinante e mortalidade em pacientes com câncer: uma meta-análise de ensaios clínicos randomizados . In: The Lancet , 2009, 373 (9674), pp. 1532-1542. PMID 19410717 .
- ↑ CL Bennet et al.: Tromboembolismo venoso e mortalidade associada à eritropoetina recombinante e administração de darbepoetina para o tratamento da anemia associada ao câncer . In: JAMA , 2008, 299, pp. 914-924.
- ↑ Tratamento com fatores de crescimento hematopoiéticos. (PDF) Status: novembro de 2008, Sociedade Alemã de Hematologia e Oncologia
- ↑ Prescreva com cautela agentes estimuladores da eritropoiese na insuficiência renal . Comunicado de imprensa, aconselhamento terapêutico, Federal Joint Committee, 22 de setembro de 2011
- ↑ S. Ritter: Erythropoietin . In: Chemical & Engineering News , 2005, No. 83 (25).
- ↑ JL Fox: FDA provavelmente irá restringir ainda mais o uso de eritropoietina para pacientes com câncer . In: Nature Biotechnology , 2007, 25, pp. 607-608. PMID 17557084 .
- ↑ Eritropoietina: Pick-me-Up e Lifesaver . ( Memento de 7 de setembro de 2005 no Internet Archive )
- ↑ Um relatório abrangente de eritropoietinas . ( Memento de 22 de fevereiro de 2014 no Internet Archive ).
- ↑ B Häussler: Artigo. Instituto IGES, 2008.
- ↑ Arnd Krüger : Jogos de EPO em Sydney também? ( Memento do originais de 31 de dezembro de 2015 na Internet Archive ) Info: O arquivo de ligação foi inserido automaticamente e ainda não foi marcada. Verifique o link original e o arquivo de acordo com as instruções e, em seguida, remova este aviso.
- ↑ Alessandro Donati: World Traffic in Doping Substances (PDF) WADA, fevereiro de 2007, (PDF, 542 KB).
- ↑ Lista Vermelha online, em setembro de 2009.



