Leucemia mielóide crônica
| Classificação de acordo com CID-10 | |
|---|---|
| C92.1 | Leucemia mielóide crônica |
| CID-10 online (OMS versão 2019) | |
| Classificação de acordo com ICD-O-3 | |
|---|---|
| 9863/3 | Leucemia mieloide crônica nos |
| ICD-O-3 primeira revisão online | |
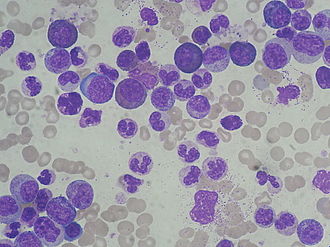
A leucemia mieloide crônica (CML) , incluindo a leucemia mielóide crônica e (raramente) chamada de mielose crônica , é uma leucemia crônica , com uma proliferação de leucócitos (glóbulos brancos), especialmente de granulócitos e seus precursores no sangue e formadores de sangue Associado à medula óssea . A doença costuma ser assintomática na fase inicial.
A CML pertence ao grupo das neoplasias mieloproliferativas (NMP), ou seja, doenças que resultam de um distúrbio (genético) das células-tronco hematopoiéticas encontradas na medula óssea . A doença descrita por Rudolf Virchow em 1845 e documentada pela primeira vez com o nome de leucemia era muito provavelmente CML.
Com o uso de drogas específicas para tumores mais recentes, os chamados inibidores da tirosina quinase , desde a virada do milênio, o prognóstico e as formas de tratamento da LMC mudaram significativamente e a doença tornou-se tratável em muitos casos com relativamente poucos lados efeitos. A CML é assim chamado de tal uso alvo terapias (Engl. Terapias específicas ) quase a uma doença modelo para toda a hematologia tornar-se ou a terapia de tumores em geral.
Epidemiologia

A LMC tem uma incidência de cerca de 1,6 novos casos por 100.000 adultos por ano e é responsável por cerca de 20 por cento de todas as leucemias. É uma doença predominantemente da idade adulta e mostra um aumento constante com o aumento da idade. Os homens têm cerca de 1,4 vezes mais probabilidade de serem afetados do que as mulheres. O diagnóstico médio ( mediano ) é feito aos 65 anos de idade; cerca de dez por cento dos pacientes têm menos de 35 anos de idade no momento do diagnóstico. Estima-se que haja cerca de 1.700 novos casos por ano para toda a Alemanha, cerca de 160 para a Suíça e cerca de 175 para a Áustria a cada ano.
Causas e origens

A causa da doença é a mudança e subsequente proliferação (reprodução) de uma única célula progenitora hematopoiética multipotente . Em quase todos os casos, a causa é uma translocação recíproca entre os cromossomos 9 e 22 (escrito: t (9; 22) (q34; q11), ou abreviado t (9; 22)). Em ambos os cromossomos envolvidos, o ponto de quebra está localizado no braço mais longo (braço q), com o cromossomo 9 mais próximo do final do que com o cromossomo 22 .
A quebra do cromossomo está em ambos os cromossomos na área dos genes, a saber, ABL (ou ABL1 ) no cromossomo 9 e BCR (" breakpoint cluster region ") no cromossomo 22. A translocação leva à formação de genes de fusão: BCR-ABL no cromossomo 22 alterado (com o final do cromossomo 9) e ABL-BCR no cromossomo 9 alterado (com o final do cromossomo 22). A translocação do cromossomo é citogeneticamente visível como um cromossomo 22 encurtado, conhecido como " cromossomo Filadélfia ".
O gene ABL codifica uma tirosina quinase e desempenha um papel importante na regulação do crescimento celular. Se o gene de fusão BCR-ABL é formado , a função do ABL é decisivamente perturbada e a atividade da tirosina quinase é permanentemente ativada. O gene BCR-ABL, portanto, atua como um oncogene e leva a uma reprodução aumentada e descontrolada da célula afetada. A translocação é adquirida ao longo da vida e não é hereditária ou hereditária, pois as células da linha germinativa não são afetadas (até onde se sabe, apenas as células do sistema formador de sangue são afetadas). Por que isso ocorre não é compreendido. Tal como acontece com as mutações em geral, a radiação ionizante ou produtos químicos são discutidos como fatores de risco para a ocorrência da mudança .
Um cromossomo Filadélfia não é detectável em todos os pacientes com LMC. Em um grande estudo prospectivo do Conselho de Pesquisa Médica , nenhum cromossomo Filadélfia pôde ser detectado citogeneticamente em cerca de 15% dos casos. Em dois terços desses pacientes negativos para o cromossomo Filadélfia, no entanto, o oncogene BCR-ABL foi detectável e o quadro clínico não diferiu significativamente daquele dos pacientes positivos para o cromossomo Filadélfia. Alguns desses pacientes apresentaram alterações cromossômicas complexas que mascararam a translocação t (9; 22). Em um terço, ou seja , cerca de cinco por cento de todos os pacientes com CML, não houve evidência de translocação t (9; 22) ou fusão BCR-ABL . O quadro clínico desta forma diferia mais claramente da LMC “típica” e tinha um prognóstico significativamente pior .
curso
O CML é executado classicamente em três fases , a fase crônica , a fase de aceleração e a crise explosiva (ou explosão repentina ). Antes do advento de novos medicamentos e antes que a opção de transplante de células-tronco de doadores saudáveis estivesse disponível, o curso da doença seguia esse curso quase regularmente. A crise explosiva foi o estágio final da doença e levou à morte do doente. Ainda hoje não é possível prever com certeza quando ocorrerá a fase acelerada e quando ocorrerá a crise blástica em um paciente. São conhecidos casos individuais de pacientes com LMC que viveram em fase crônica por mais de 20 anos. Em outros pacientes, a fase acelerada e a crise blástica ocorreram logo após o diagnóstico. Hoje, as crises blásticas tornaram-se mais raras, pois existem boas opções de tratamento para a fase crônica. Ocasionalmente, no entanto, eles ainda são diagnosticados (geralmente como a "primeira manifestação" da LMC).
Fase crônica
O início da doença é lento e insidioso e muitas vezes passa despercebido por anos. Os principais sintomas desta fase são leucocitose (aumento dos glóbulos brancos) e esplenomegalia (aumento do baço). A esplenomegalia é explicada pelo crescente deslocamento da formação de sangue saudável da medula óssea, de modo que a formação de sangue extramedular ocorre no baço e, posteriormente, também no fígado. O diagnóstico geralmente é feito nesta fase e não é incomum que seja um diagnóstico casual, por exemplo, com base em um hemograma que revela leucocitose. No hemograma diferencial , além dos granulócitos maduros , há precursores imaturos da série mieloide até os mieloblastos (o chamado desvio à esquerda patológico ). A proporção de células completamente imaturas (blastos) é inferior a dez por cento.
Fase de aceleração
A fase de aceleração ( lat. Accelerare = acelerar) é uma fase de transição entre a fase crônica e a explosão, na qual a doença ganha impulso. É caracterizada pelo aumento da leucocitose, anemia ( anemia ), trombocitopenia (falta de plaquetas sanguíneas ) e aumento do inchaço do baço. A contagem diferencial de sangue mostra uma proporção de explosões de dez a 30 por cento. A análise citogenética frequentemente mostra novas alterações cromossômicas além do cromossomo Filadélfia (mais comum: isocromossomo 17, um segundo cromossomo Filadélfia, trissomia dos cromossomos 8 ou 19). O bem-estar subjetivo geral do paciente se deteriora. Se o paciente está em tratamento quimioterápico, o efeito da medicação está diminuindo e a dose deve ser aumentada.
Crise de explosão
A crise blástica ocorre relativamente repentinamente após a fase de aceleração ou diretamente fora da fase crônica. Na crise blástica, a doença muda seu caráter de um curso crônico, bastante lento, para um curso que corresponde ao da leucemia aguda. A crise explosiva é definida por:
- Proporção de blastos no sangue periférico e / ou medula óssea ≥ 30 por cento (de acordo com os critérios do grupo de estudo alemão CML) ou ≥ 20 por cento (de acordo com a definição da OMS), e / ou
- infiltrados blásticos confirmados citológica ou histologicamente (acumulação de grandes quantidades de células CML no tecido) fora da medula óssea, baço ou nódulos linfáticos. Esses infiltrados também são conhecidos como cloromas .
As explosões em cerca de dois terços de todas as crises blásticas mostram um fenótipo imunológico mieloide ou completamente indiferenciado . O terço restante possui imunofenótipo linfático. No último caso, geralmente é difícil ou impossível diferenciar a crise blástica de uma leucemia linfoblástica aguda positiva para o cromossomo Filadélfia sem o conhecimento da história anterior . Os vários transcritos de mRNA - BCR-ABL - , cuja distribuição relativa difere na LMC e na LLA, dão uma certa indicação . O estágio da crise blástica termina de forma relativamente rápida (dentro de semanas) e fatal se não for tratada.
Diagnóstico
a) Citologia da medula óssea: típico da LMC é um aumento em todas as quatro fileiras de células de mielopoiese: trombopoiese (formação de plaquetas), granulopoiese (formação de granulócitos), monopoiese (formação de monócitos) e eritropoiese (formação de eritrócitos). Como regra, aparece uma “medula completa (ou seja, osso rico em células)”. A granulocitopoiese é a que mais aumenta e ganha vantagem na fase tardia da doença, em detrimento das outras fileiras de células. No entanto, há mudanças quantitativas e qualitativas com megacariócitos, às vezes incomumente pequenos ("micromegacariócitos"), e muitas vezes também um aumento de basófilos e / ou eosinófilos .
b) Citogenética e genética molecular: detecção de 95 por cento do cromossomo Filadélfia e / ou do oncogene BCR-ABL no sangue e na medula óssea. A falta dessas mudanças é prognosticamente menos favorável. A detecção de BCR-ABL em uma doença mieloproliferativa é conclusiva para o diagnóstico de LMC. Às vezes, o cromossomo Filadélfia também é encontrado na leucemia linfoblástica aguda .
c) contagem do sangue e dos parâmetros de química clínica do sangue: trombocitose (na fase inicial) em um terço dos pacientes (risco de trombose),! neutrofilia com pronunciada eosino- e basofilia e deslocamento para a esquerda (aumento em precursores imaturos da granulócitos ) e anemia moderada . Na fase crônica, entretanto, existem apenas alguns blastos em contraste com a leucemia mieloide aguda, apesar do grande aumento na contagem de leucócitos. Na LMC, podem ser obtidas contagens de leucócitos de até 500.000 / µl (valor normal <10.000 / µl). Além disso, em contraste com as células linfocíticas na leucemia linfocítica crônica (CLL) ou leucemia prolinfocítica (PLL), que também têm contagens de leucócitos altas no sangue, as células CML mostram uma tendência de aderir umas às outras ("pegajosidade"). Portanto, em valores tão elevados, há um risco agudo de sintomas de leucostase , ou seja, a capacidade de fluxo do sangue não é mais garantida. Como resultado, podem ocorrer tromboses e distúrbios circulatórios nesta fase (trombose venosa da retina , enfarte do baço, priapismo doloroso devido à trombose do tecido eréctil , enfarte cerebral , enfarte do miocárdio ).
d) Citoquímica: O índice ALP como expressão da atividade da fosfatase leucocitária alcalina nos neutrófilos é geralmente reduzido. Hoje em dia, no entanto, esta disposição perdeu quase completamente o seu significado.
Como expressão do aumento da renovação celular, a atividade da lactato desidrogenase (LDH) e o nível de ácido úrico no sangue geralmente estão aumentados.
terapia
Objetivos da terapia geral
O objetivo da terapia é suprimir a doença, tanto quanto possível, com efeitos colaterais justificáveis. Para medir a eficácia do tratamento, os seguintes termos são usados:
- resposta hematológica ( resposta hematológica) , ou seja, o grau de normalização dos hemogramas e regressão da esplenomegalia; a resposta hematológica é determinada pelo exame clínico e pelo diferencial de hemograma;
- resposta citogenética ( resposta citogenética) , d. H. Porcentagem de células nas quais o cromossomo Filadélfia Ph + pode ser detectado citogeneticamente ;
- resposta molecular ( resposta molecular) , ou seja, a medição do mRNA de BCR-ABL por reação em cadeia da polimerase quantitativa (PCR)
Os seguintes termos são definidos na linguagem médica internacional:
Resposta hematológica
Como resposta hematológica completa ( resposta hematológica completa , CHR) é referida, isto é, a normalização completa das contagens sanguíneas e sintomas clínicos. H. Plaquetas abaixo de 450 × 10 9 / l, leucócitos abaixo de 10 × 10 9 / l, uma contagem sanguínea diferencial sem precursores de granulócitos imaturos (mielócitos, promielócitos, mieloblastos) e com menos de cinco por cento de basófilos e sem esplenomegalia palpável.
Resposta citogenética
A resposta citogenética é medida por meio de um exame citogenético . A porcentagem de metáfases com uma translocação detectável na Filadélfia é determinada.
- Resposta citogenética completa ( resposta citogenética completa , CCyR): Ph + 0 por cento
- Resposta citogenética parcial ( resposta citogenética parcial , PCyR): Ph + 1-35 por cento
- Resposta citogenética baixa ( resposta citogenética menor , MiCyR): Ph + 36-65 por cento
- Resposta citogenética mínima ( resposta citogenética mínima) : Ph + 66-95 por cento
- Sem resposta citogenética (sem resposta citogenética) : Ph +> 95%
Resposta Molecular
A resposta molecular é medida usando RT-PCR . Para garantir a comparabilidade entre diferentes laboratórios, foi desenvolvida uma escala internacional (SI).
- Resposta molecular completa ( resposta molecular completa , CMR): BCR-ABL não detectável
- Resposta molecular ( resposta molecular principal , MMR): BCR-ABL ≤ 0,10 IS
Em termos simples, pode-se dizer que, com uma resposta hematológica completa, a porcentagem de células CML no sangue / medula óssea pode estar no máximo na faixa de porcentagem inferior de dois dígitos, com uma resposta citogenética completa no máximo na faixa inferior faixa de porcentagem de um dígito e com uma resposta molecular completa está abaixo da faixa do álcool.
Medicamento
Hidroxicarbamida
A normalização da contagem de leucócitos muitas vezes pode ser alcançada com o uso de hidroxicarbamida (hidroxiureia, inglês: hidroxiureia, HU). Este medicamento citostático está no mercado há muito tempo. Inibe a conversão de ribonucleotídeos em desoxirribonucleotídeos e também é eficaz nas outras doenças mieloproliferativas mencionadas acima. As dosagens típicas são um comprimido de 500 mg a cerca de quatro comprimidos (= dois gramas) por dia.
Os efeitos colaterais são raros, ocasionalmente leves náuseas, muito raramente lesão da mucosa ou toxicidade hepática . Essa terapia torna possível reduzir o número de leucócitos no sangue quase de volta à faixa normal (5.000 a 10.000 / μl). No entanto, essa normalização não tem influência duradoura no curso da doença. Após uma média de três anos, a condição se deteriora ainda mais e a fase de aceleração começa. A sobrevida média de pacientes tratados com hidroxicarbamida é ligeiramente maior do que a de pacientes completamente não tratados e foi de aproximadamente 4 anos e meio em estudos históricos de terapia.
O uso de hidroxicarbamida na CML agora só é útil em certas situações, por exemplo, se contagens muito altas de leucócitos devem ser reduzidas na fase inicial do tratamento, ou se o uso de TKI (ver abaixo) não é possível devido a intoleráveis efeitos colaterais, ou se o paciente tem uma expectativa de vida muito curta devido a outras doenças existentes (por exemplo, câncer avançado).
Interferon-α
O interferon alfa (α) (IFN-α) é uma citocina produzida e liberada pelos leucócitos; que serve a resposta imunológica a infecções virais e bacterianas infecções e induz, entre outras coisas, uma inibição da proliferação nas células alvo, por exemplo, no caso de um ataque de vírus. Também aumenta a atividade das células T citotóxicas e macrófagos . O interferon é geralmente injetado por via subcutânea 3 vezes por semana . As dosagens típicas são de 3 × 0,5 a 3 × 6 milhões de unidades por semana. Pode ser administrado em monoterapia ou em combinação com outros medicamentos. Freqüentemente, o interferon-α é uma droga que não é muito bem tolerada. Você pode sentir sintomas semelhantes aos da gripe, mas eles ocorrem dependendo da dose. Em muitos casos, a terapia com interferon afeta a capacidade de concentração e de memória ; pode ocorrer depressão , bem como tonturas , confusão e polineuropatias . O tratamento também afeta o trato digestivo e o fígado .
Inibidores de tirosina quinase (TKIs)
A terapia específica pode ser usada em pacientes com BCR-ABL positivo. Desde a virada do milênio, existem drogas que podem inibir especificamente a atividade da enzima tirosina quinase do componente ABL do BCR-ABL de forma competitiva . Esses inibidores da tirosina quinase revolucionaram o tratamento da LMC e levaram a uma melhora dramática nos resultados do tratamento. É feita uma distinção entre os inibidores de tirosina quinase (TKIs) de primeira, segunda e terceira geração, que chegaram ao mercado um após o outro. O mais importante TKI de primeira geração é o imatinibe . O composto recebeu aprovação para o tratamento da LMC na Europa e nos Estados Unidos em 2001 e 2003, respectivamente. Os TKIs de segunda geração são nilotinibe e dasatinibe , os TKIs de terceira geração são bosutinibe e ponatinibe .
Os inibidores da tirosina quinase são agora considerados o " padrão ouro " medicinal do tratamento da LMC.
Imatinib e o estudo IRIS
A eficácia e a superioridade do imatinibe em relação a todos os outros tratamentos medicamentosos anteriormente conhecidos foi em um grande ensaio de tratamento internacional de fase III com mais de 1000 pacientes com LMC, denominado estudo IRIS , significativamente ( IRIS. = I nternational R andomized Study of I nterferon and S TI571 ). O estudo da terapia IRIS foi originalmente planejado como um estudo comparativo de dois braços . H. metade dos pacientes deve receber imatinibe como tratamento e a outra metade deve receber o tratamento padrão de interferon-α e citarabina. No entanto, a superioridade do tratamento com imatinibe já ficou clara na primeira avaliação intermediária com um tempo médio de observação de 18 meses. Os pacientes tratados com imatinibe tiveram uma boa resposta citogenética (ver definições de termos acima) de 87,1 por cento e uma resposta citogenética completa de 76,2 por cento. No grupo do interferon-α / citarabina, os números correspondentes foram 34,7 por cento e 14,5 por cento. No grupo de pacientes tratados com imatinibe, 96,7 por cento não apresentaram progressão da doença para a fase de crise blástica / aceleração, enquanto foi de 91,5 por cento no grupo de interferon-α / citarabina. No geral, o tratamento com imatinibe também foi melhor tolerado do que o tratamento com interferon α / citarabina.
Esses resultados levaram ao fato de que a maioria dos pacientes no grupo do interferon-α / citarabina mudou para o braço de tratamento com imatinibe (este cruzamento foi permitido dentro do escopo do estudo IRIS ). Além disso, a American Food and Drug Administration e a European Medicines Agency (principalmente com base nos resultados do estudo IRIS ) aceleraram a aprovação do imatinibe para o tratamento da LMC e , como resultado, muitos pacientes que foram incluídos no estudo IRIS esquerdo O interferão-α / citarabina tratou o estudo e continuou o tratamento fora do estudo com imatinib. O estudo IRIS , portanto, mudou de um estudo inicial de dois braços para um estudo puramente observacional para o tratamento de pacientes com LMC com imatinibe.
Uma atualização dos dados do estudo IRIS publicados em 2009 mostrou sobrevida livre de progressão de 92 por cento dos pacientes com um tempo médio de observação de oito anos para pacientes tratados com imatinibe desde o início.
O imatinibe se tornou o medicamento padrão para o tratamento da LMC após o anúncio dos resultados do estudo IRIS . No entanto, ainda não há consenso sobre a dose ideal de imatinibe. A dose usual é de 400 mg por dia. O estudo alemão da terapia CML IV examina se uma dose diária de 800 mg é tolerada e produz melhores resultados. De acordo com as avaliações iniciais, parece que os pacientes mais velhos (≥ 65 anos de idade) atingem a remissão significativamente mais rápido com 800 mg de imatinibe do que com 400 mg de medicação, o que, no entanto, deve ser pago com maiores efeitos colaterais. A conclusão desta análise foi que a dose de imatinibe em pacientes ≥ 65 anos deve ser preferencialmente superior a 400 mg por dia. Parece certo que a dose diária geralmente não deve ser significativamente inferior a 400 mg, pois isso promove o desenvolvimento de resistência. Entretanto, a situação mudou devido ao facto de estarem disponíveis inibidores da tirosina quinase mais recentes da segunda ou terceira geração (ver abaixo). Nas diretrizes atuais, nenhum TKI específico é explicitamente recomendado, apenas especificações são feitas para os objetivos da terapia que devem ser alcançados.
O imatinibe geralmente é relativamente bem tolerado. Os efeitos colaterais podem incluir náuseas e vômitos (raramente), edema , derrames pleurais e pericárdicos (acúmulo de líquido na pleura ou pericárdio ), aumento das transaminases , cãibras musculares e erupções cutâneas .
Nilotinibe e dasatinibe: TKIs de segunda geração
Apesar do notável sucesso do tratamento com imatinibe, cerca de 20 a 25 por cento dos pacientes com LMC irão requerer terapia alternativa dentro de 5 a 8 anos de tratamento com imatinibe. As razões para isso são principalmente eficácia insuficiente, perda de eficácia do imatinibe ou intolerância ao imatinibe. Nessa situação, há duas alternativas principais, uma é mudar para um inibidor de tirosina quinase diferente e a outra é realizar um transplante alogênico de células-tronco ou medula óssea. A causa da perda de eficácia pode ser uma mutação na área dos domínios da tirosina quinase do gene BCR-ABL .
Dois novos inibidores da tirosina quinase de segunda geração, dasatinib (nome comercial Sprycel ) e nilotinib (nome comercial Tasigna ), foram agora aprovados para o tratamento da LMC no caso de resistência ou intolerância ao imatinib. Tanto o dasatinibe quanto o nilotinibe são significativamente mais eficazes na inibição da ABL quinase in vitro e também são eficazes contra a maioria das resistências ao imatinibe. Apenas no caso da mutação T315I as duas substâncias são ineficazes. Existe uma mutação genética que leva à troca de aminoácidos treonina → isoleucina na posição 315. Os resíduos de isoleucil são consideravelmente maiores do que os resíduos de treonil e, portanto, possivelmente evitam que o fármaco se ligue ao local de ligação específico.
Que começou em 2013. Estudo de terapia TIGER alemão (TIGER = T asigna / I nterferon na Alemanha ) se transforma completamente (em parte em um estágio posterior em combinação com interferon α) em nilotinibe. No contexto deste estudo, o imatinibe deve ser administrado apenas em caso de intolerância ao nilotinibe, enquanto dasatinibe (ou transplante de células-tronco alogênico) deve ser usado se ocorrer resistência ao nilotinibe.
Terceira geração TKI
Outros TKI recentes são o Bosutinibe ( Bosulif ) e o ponatinibe ( Iclusig ), ambos aprovados em 2012 nos Estados Unidos para o tratamento da LMC com intolerância ou inefetividade de outros TKI. Poucos meses depois, também foi aprovado na Europa. O ponatinibe, em particular, é de grande interesse, pois também é eficaz contra a mutação BCR-ABL T315I.
Resistência a inibidores de tirosina quinase
Durante a terapia com inibidores da tirosina quinase, às vezes ocorre o fenômeno de que o efeito da droga é cada vez mais enfraquecido e, por fim, completamente perdido. O primeiro indicador disso é um aumento no nível de BCR-ABL (que geralmente é medido no sangue a cada três meses durante a terapia). Se nenhuma ação for tomada, a doença se espalhará novamente e seguirá o curso descrito acima . Nesses casos, fala-se de resistência ao medicamento, por exemplo, resistência ao imatinibe ou resistência ao nilotinibe.
Essas resistências são frequentemente causadas por mutações de nucleotídeos no oncogene BCR-ABL , que levam a trocas de aminoácidos . A droga, então, não mostra mais nenhum efeito contra a proteína BCR-ABL mutada. Presume-se agora que a maioria dessas mutações já está presente em pequenas quantidades no início da terapia e são então selecionadas por terapia (apenas o clone mutado, isto é, resistente pode crescer). No entanto, algumas das mutações provavelmente também ocorrem aleatoriamente durante o curso da doença. Muitas mutações BCR-ABL foram caracterizadas nos últimos anos. De interesse clínico é o fato de que algumas mutações BCR-ABL conferem resistência a um inibidor da tirosina quinase, mas são sensíveis a outros. Nesses casos, faz sentido mudar para um inibidor de tirosina quinase diferente. Em uma declaração de consenso de um grupo de especialistas do European LeukemiaNet de 2011, o seguinte procedimento foi recomendado ao detectar mutações durante a terapia com imatinibe:
- T315I : transplante alogênico ou terapia experimental;
- V299L , T315A , V517L / V / I / C : nilotinib em vez de dasatinib;
- Y253H , E255K / V , F359V / C / I : dasatinib em vez de nilotinib;
- qualquer outra mutação: dose mais alta de imatinibe ou dasatinibe ou nilotinibe.
No entanto, há também o fenômeno da resistência sem que uma mutação BCR-ABL seja detectada. Obviamente, existem outras alterações genéticas que ainda não são bem compreendidas. Nessa situação, pode ser útil a troca do inibidor da tirosina quinase ou o aumento da dose do previamente administrado.
Objetivos da terapia na terapia TKI
Em 2013, os comitês de especialistas formularam recomendações para os objetivos terapêuticos a serem alcançados. Nenhum TKI específico (por exemplo, imatinibe, nilotinibe, dasatinibe, etc.) foi expressamente recomendado. Os objetivos terapêuticos para o tratamento com inibidores da tirosina quinase são uma resposta hematológica completa (CHR) após três meses no máximo, uma resposta citogenética completa (CCyR) após seis meses no máximo, e uma extensa remissão molecular (MMR) após 18 meses em o mais recente. Se houver avisos, é recomendado realizar verificações correspondentemente mais frequentes (por exemplo, até 1 × medição BCR-ABL mensal ); se houver uma falha na terapia, a terapia deve ser alterada.
| Critérios para avaliar a eficácia da terapia com TKI | |||
|---|---|---|---|
| Tempo | Ótimo | Avisos de alerta | Falha de terapia |
| Tempo de diagnóstico | Não aplicável | Alto risco (veja as pontuações de risco abaixo), aberrações cromossômicas adicionais em células Ph + |
Não aplicável |
| 3 meses após o diagnóstico |
BCR-ABL ≤ 10% e / ou metáfases Ph + ≤ 35% |
BCR-ABL > 10% e / ou metáfases Ph + 35 a 95% |
sem remissão hematológica completa (CHR) e / ou metáfases Ph +> 95% |
| 6 meses após o diagnóstico |
BCR-ABL ≤ 1% e / ou metáfases Ph + 0% |
BCR-ABL 1 a 10% e / ou metáfases Ph + 1 a 35% |
BCR-ABL > 10% e / ou metáfases Ph +> 35% |
| 12 meses após o diagnóstico | BCR-ABL ≤ 0,1% | BCR-ABL 0,1% a 1% |
BCR-ABL > 1% e / ou metáfases Ph +> 0% |
| em qualquer momento posterior | BCR-ABL ≤ 0,1% (MMR) | aberrações clonais citogenéticas | Perda de uma remissão citogenética completa e / ou perda de uma remissão hematológica e / ou confirmada (!) Perda de uma remissão molecular extensa (MMR) e / ou evidência de mutações BCR-ABL |
Transplante de medula óssea ou células-tronco do sangue
O transplante alogênico de células-tronco (SCT) (mais raramente o transplante de medula óssea KMT), de acordo com os conhecimentos atuais, pode resultar na única terapia que demonstrou uma cura completa . Existem também pacientes isolados nos quais a terapia com inibidores da tirosina quinase faz com que o gene de fusão BCR-ABL não seja mais detectável . No entanto, não está claro aqui se é uma questão de curas reais ou apenas empurrar a doença abaixo do limite de detecção. Uma vez que quanto mais cedo o SCT / KMT for realizado, o prognóstico é melhor, uma decisão deve ser tomada o mais cedo possível. O problema com esse transplante é a mortalidade relativamente alta de complicações (especialmente infecções graves) durante o procedimento de transplante e a possível ocorrência de doenças graves de autoagressão após o transplante ( doença do enxerto contra o hospedeiro , GvHD).
Esse efeito pode surgir porque todo o sangue e as células de defesa do corpo são formadas a partir das células-tronco da medula óssea. Portanto, não é apenas a formação do sangue que é substituída, mas partes essenciais do sistema imunológico são transplantadas. Embora um efeito hospedeiro versus enxerto ('receptor versus transplante'), ou seja, uma reação de rejeição típica , possa ser observado em transplantes convencionais , aqui o sistema imunológico transplantado é direcionado contra o novo corpo. Por esse motivo, o SCT / KMT também deve ser precedido por uma quimioterapia agressiva ao máximo , a fim de destruir o sistema imunológico do próprio corpo da maneira mais completa possível. O estabelecimento das novas células-tronco pode ser severamente interrompido por um sistema imunológico remanescente.
O efeito enxerto-versus-hospedeiro não é apenas desvantajoso para o paciente: alguns dos receptores de transplante podem se beneficiar com o novo sistema imunológico que combate as células tumorais remanescentes. Esse efeito é chamado de reação enxerto versus leucemia (reação GvL).
Um transplante só é realizado se:
- Pacientes nos quais o tratamento com imatinibe ou inibidores de tirosina quinase mais recentes é ineficaz,
- pacientes mais jovens e
- Pacientes para os quais pode ser encontrado um doador compatível (doadores familiares ou terceiros).
Custos de terapia
| medicamento | Dosagem típica por dia |
Custos diários da terapia |
|---|---|---|
| Glivec | 400 mg | 113 € |
| Tasigna | 600 mg | 134 € |
| Sprycel | 100 mg | 189 € |
| Roferon A. | 3 × 6 milhões de UI (por semana) |
€ 31 |
| Litalir | 1 g | 4,30 € |
| Nota: Esta tabela não tem a intenção de sugerir que os medicamentos listados têm efeito equivalente. Apenas os custos da terapia são comparados aqui. Existem grandes diferenças em termos de eficácia. | ||
O medicamento padrão Imatinib está disponível na forma de comprimido em doses de 100 mg ou 400 mg. A dose padrão é 400 mg de imatinibe por dia. O preço da farmácia alemã para a embalagem de Glivec com 90 comprimidos de 400 mg é de € 10.120,86 (equivalente a € 112,45 por comprimido). As embalagens Sprycel de 56 comprimidos de 50 mg cada custam € 5291,92, o que corresponde a um preço de terapia diária de € 189 para a dose diária habitual de 100 mg. Tasigna está disponível na dosagem de 150 mg (112 cápsulas) a um preço de aproximadamente 3752,26 €, que com a dose diária usual de 600 mg acarreta custos de terapia diários de 134 €. Os custos dos medicamentos para um paciente com LMC estão entre cerca de € 41.200 ( Glivec ), € 69.000 ( Sprycel ) e € 48.779 ( Tasigna ) por ano.
Para comparação: o tratamento com hidroxicarbamida (hidroxiureia, por exemplo Litalir ) com uma dose diária de 1 g acarreta custos anuais de terapia de aproximadamente 1.600 €, com interferon alfa (por exemplo Roferon 3 × 6 milhões UI por semana) custos anuais de aprox. 11.500 €.
O fato de cinco inibidores de tirosina quinase diferentes e altamente eficazes de diferentes fabricantes estarem agora no mercado (em julho de 2013: Imatinibe e Nilotinibe da Novartis , Dasatinibe da Bristol-Myers Squibb , Bosutinibe da Pfizer , Ponatinibe da Ariad Pharmaceuticals ) foi criticado , mas os custos da terapia ainda são exorbitantes e estão até aumentando. Em um artigo publicado em maio de 2013 na prestigiosa revista americana Blood , um coletivo internacional de mais de 100 especialistas criticou claramente os altos preços da medicina tumoral moderna, especialmente usando o exemplo da CML, e apontou que tais preços não seriam acessíveis para qualquer sistema de saúde a longo prazo ser. Mesmo em países altamente desenvolvidos, como os Estados Unidos ou a Suécia, existe um número significativo de pacientes que, devido aos altos custos dos medicamentos, não podem pagar por essa terapia e, portanto, têm menor sobrevida. Dos cerca de 1,2 a 1,5 milhões de sofredores de LMC em todo o mundo, apenas cerca de 235.000 a 250.000, ou seja, 20 a 25%, são tratados com o medicamento padrão imatinibe, o que se deve em grande parte aos altos custos da terapia. Também foi apontado que havia diferenças de preços significativas entre os diferentes países. Os custos anuais da terapia com imatinibe foram fornecidos para diferentes países (em US $ 1.000): EUA 92, Alemanha 54, Grã-Bretanha 34, França 40, Itália 31, Coreia do Sul 29, Japão 43, Rússia 24. A principal razão do extremo custos diferentes eram as diferentes especificações legislativas que levavam a diferentes liberdades nos preços do fabricante.
A disputa legal entre a empresa Novartis e a Índia sobre a validade da proteção da patente do Glivec (Imatinibe) na Índia também despertou considerável interesse internacional . Por fim, a Novartis foi derrotada em 1º de abril de 2013 perante a Suprema Corte da Índia, com o resultado de que o imatinibe também está disponível como medicamento genérico de outros fabricantes na Índia .
Os custos de um transplante alogênico de células-tronco, incluindo o tratamento de acompanhamento, são estimados em cerca de € 150.000, embora este valor se refira apenas ao tratamento de acompanhamento imediato. Se complicações surgirem posteriormente, como doença do enxerto contra hospedeiro crônica, os custos totais reais podem ser muito maiores. Não é incomum que pacientes transplantados percam sua capacidade de trabalhar e / ou empregar, de modo que os custos “econômicos” totais são significativamente mais elevados.
previsão
| Pontuação | considerados parâmetros clínicos e sanguíneos |
Link da Web para cálculo |
|---|---|---|
| Pontuação EUTOS | Tamanho do baço basófilos |
eutos.org |
| Pontuação de Sokal Hasford | Idade Baço Tamanho Plaquetas Basófilos Eosinófilos Mieloblastos |
leucemia-net.org |
Taxas de sobrevivência em uma visão geral histórica
Antes que os medicamentos estivessem disponíveis, a LMC era a doença do grupo de neoplasia mieloproliferativa (NMP) com pior prognóstico. A sobrevida média de pacientes com LMC sem tratamento foi de apenas cerca de três a quatro anos. A hidroxicarbamida conduziu a uma ligeira melhoria para aproximadamente 4½ anos e o interferão subsequentemente conduziu a uma melhoria adicional na sobrevida média para aproximadamente 5½ anos.
Hoje, as taxas de sobrevivência de cinco anos com tratamento com imatinibe são de cerca de 90 por cento ou até mais. Mesmo com mais de 10 anos de acompanhamento para pacientes tratados com imatinibe, a “sobrevida média do ponto final” ainda não foi alcançada.
Transplante de células-tronco em CML
A sobrevida de dez anos dos pacientes tratados com imatinibe é significativamente maior do que após o transplante de células-tronco , onde as taxas de sobrevida são historicamente de cerca de 55 por cento após dez anos (veja a tabela de pontuações de risco). Com os transplantes de células-tronco, um número significativo de pacientes morre como resultado de tratamento intensivo, infecções graves ou doença do enxerto contra o hospedeiro . Os pacientes sobreviventes após o transplante de células-tronco muitas vezes também têm que lutar contra o problema da doença enxerto-contra-hospedeiro crônica, de modo que não precisam mais tomar imatinibe, mas sim tomar outros medicamentos contra a doença GvH.
Hoje, portanto, não se justifica mais, como no passado, enviar pacientes com LMC a um transplante imediatamente após o diagnóstico. No entanto, pode fazer sentido realizar um transplante em pacientes individuais de alto risco durante o curso da doença se, por exemplo, eles não responderem ao tratamento com imatinibe ou outros inibidores da tirosina quinase e estiverem em boas condições gerais. Após dez anos, 40% dos grupos de alto risco ainda estão vivos com a terapia com interferon-α, apenas 20% dos grupos de alto risco.
Cura completa sem transplante de células-tronco?
De acordo com a opinião convencional, uma cura completa no sentido de um desaparecimento completo do oncogene BCR-ABL não pode ser alcançada na maioria dos casos com os inibidores da tirosina quinase anteriores (imatinibe, nilotinibe, dasatinibe) ou com interferon-α. Existem pacientes nos quais o imatinibe ou o nilotinibe funcionam tão bem que o oncogene BCR-ABL não pode mais ser detectado, mesmo com os métodos de medição mais sensíveis. Em casos individuais, não está claro se esses pacientes podem ser considerados curados ou se a sensibilidade da medição do método de exame é simplesmente insuficiente para detectar as poucas células remanescentes da LMC. No momento, portanto, geralmente não é recomendado nesses casos omitir a medicação de forma descontrolada, pois se teme uma recorrência da doença.
Estudos clínicos estão em andamento, nos quais, entre outras coisas, está sendo investigado se as últimas células-tronco CML restantes podem ser eliminadas e, assim, o paciente completamente curado com a negatividade BCR-ABL acima descrita com abordagens imunoterapêuticas ( por exemplo, interferon). O estudo da terapia alemã TIGER mencionado acima, que começou em 2013, examina essa abordagem terapêutica. O plano aqui é tratar os pacientes principalmente com nilotinibe (e em alguns casos também com interferon). Para pacientes que alcançam remissão molecular completa com duração de mais de 2 anos, uma tentativa de eliminação completa deve ser feita - é claro, com monitoramento molecular contínuo adicional - para ver se os pacientes estão curados permanentemente.
literatura
- Bubnoff, Nikolas von; Duyster, Justus: Leucemia Mielóide Crônica: Terapia e Monitoramento . In: Dtsch Arztebl Int . Não. 107 (7) , 2010, pp. 114-121 ( resumo ).
- Ludwig Heilmeyer , Herbert Begemann: sangue e doenças do sangue. In: Ludwig Heilmeyer (Hrsg.): Livro didático de medicina interna. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2ª edição ibid. 1961, pp. 376-449, aqui: pp. 424-426: Die chronisch-myeloische Leukemia (mielose leucêmica crônica).
Links da web
- Informações sobre a doença CML. CML-Info.com
- Oncologia, Hematologia - Dados e Informações. CML ONKODIN
- Informações de pacientes para pacientes. Leucemia Online
- Guia de leucemia mieloide crônica
Evidência individual
- ↑ Diretrizes para leucemia mielóide crônica. Sociedade Alemã de Hematologia e Oncologia (DGHO), setembro de 2013, acessado em 19 de março de 2016 .
- ↑ Junia V. Melo, David J. Barnes: Leucemia mieloide crônica como um modelo de evolução da doença no câncer humano . In: Nature Reviews Cancer . fita 7 , 2007, p. 441-453 , PMID 17522713 ( nature.com [acessado em 8 de agosto de 2011]).
- ↑ a b Fichas técnicas do SEER: Leucemia mieloide crônica. Vigilância, Epidemiologia e Resultados Finais (SEER), acessado em 2 de junho de 2011 (com base em dados de 2004-2008).
- ↑ CA Schiffer: inibidores de tirosina quinase BCR-ABL para leucemia mielóide crônica. In: N Engl J Med . 2007; 357, pp. 258-265. PMID 17634461
- ↑ Os números para a Alemanha são baseados em estimativas da Rede de Competência aguda e leucemia crônica weblink , os valores relativos à Áustria e Suíça são estimados na proporção das figuras alemãs
- ↑ a b c A. Hochhaus: Leucemia mieloide crônica (CML). Em: S. Seeber, J. Schütte (Ed.): Therapy Concepts Oncology . Springer-Verlag, Heidelberg 2007, ISBN 978-3-540-28588-5 , página 293.
- ^ A b D. G. Savage e outros: Características clínicas no diagnóstico em 430 pacientes com leucemia mieloide crônica vista em um centro de referência durante um período de 16 anos. In: Ir. J Haematol . 1997; 96, pp. 111-116. PMID 9012696 .
- ↑ do grego antigo χλωρός chlōrós "verde pálido / claro, verde-amarelo". Os infiltrados aparecem ligeiramente verdes quando processados pelo patologista.
- ↑ European LeukemiaNet: recomendações CML
- ↑ a b c R. Hehlmann, H. Heimpel, J. Hasford, HJ Kolb, H. Pralle, DK Hossfeld, W. Queisser, H. Löffler, A. Hochhaus, B. Heinze et al.: Comparação aleatória de interferon- alfa com bussulfano e hidroxiureia na leucemia mielóide crônica. Grupo de estudo alemão CML. In: Blood. 1994; 84 (12), pp. 4064-4077. PMID 7994025 .
- ^ A b SG O'Brien, F. Guilhot, RA Larson, I. Gathmann, M. Baccarani, F. Cervantes, JJ Cornelissen, T. Fischer, A. Hochhaus, T. Hughes, K. Lechner, JL Nielsen, P Rousselot, J. Reiffers, G. Saglio, J. Shepherd, B. Simonsson, A. Gratwohl, JM Goldman, H. Kantarjian, K. Taylor, G. Verhoef, AE Bolton, R. Capdeville, BJ Druker; Investigadores IRIS: Imatinibe comparado com interferon e citarabina em baixa dose para leucemia mieloide crônica em fase crônica recém-diagnosticada. In: N Engl J Med. 2003; 348, pp. 994-1004. PMID 12637609
- ↑ FDA infopage Gleevec (mesilato de imatinibe) , especialmente histórico regulatório, incluindo cartas de aprovação e análises de Drugs @ FDA
- ↑ Relatório de Avaliação Público Europeu (EPAR): Glivec da Agência Europeia de Medicamentos (pdf)
- ↑ M. Baccarani, J. Cortes, F. Pane, D. Niederwieser, G. Saglio, J. Apperley, F. Cervantes, M. Deininger, A. Gratwohl, F. Guilhot, A. Hochhaus, M. Horowitz, T Hughes, H. Kantarjian, R. Larson, J. Radich, B. Simonsson, RT Silver, J. Goldman, R. Hehlmann; European LeukemiaNet: Leucemia mieloide crônica: uma atualização de conceitos e recomendações de gestão da European LeukemiaNet. J Clin Oncol . 2009; 27 (35), pp. 6041-6051. PMID 19884523
- ↑ U. Proetel, N. Pletsch, M. Lauseker, MC Müller, B. Hanfstein, SW Krause, L. Kalmanti, A. Schreiber, D. Heim, GM Baerlocher, WK Hofmann, E. Lange, H. Einsele, M Wernli, S. Kremers, R. Schlag, L. Müller, M. Hänel, H. Link, B. Hertenstein, M. Pfirrman, A. Hochhaus, J. Hasford, R. Hehlmann, S. Saußele; Grupo Alemão de Estudo da Leucemia Mielóide Crônica; Grupo de Trabalho Suíço para Pesquisa Clínica do Câncer (SAKK): Pacientes mais velhos com leucemia mieloide crônica (≥65 anos) lucram mais com doses mais altas de imatinibe do que pacientes mais jovens: uma subanálise do Estudo CML randomizado IV. In: Ann Hematol. Julho de 2014; 93 (7), pp. 1167–1176. PMID 24658964 .
- ↑ a b c M. Baccarani, MW Deininger, G. Rosti, A. Hochhaus, S. Soverini, JF Apperley, F. Cervantes, RE Clark, JE Cortes, F. Guilhot, H. Hjorth-Hansen, TP Hughes, HM Kantarjian, DW Kim, RA Larson, JH Lipton, FX Mahon, G. Martinelli, J. Mayer, MC Müller, D. Niederwieser, F. Pane, JP Radich, P. Rousselot, G. Saglio, S. Saußele, C. Schiffer, R. Silver, B. Simonsson, JL Steegmann, JM Goldman, R. Hehlmann: recomendações European LeukemiaNet para a gestão da leucemia mieloide crônica: 2013. In: Blood. 2013; 122 (6), pp. 872-884. doi: 10.1182 / blood-2013-05-501569 . PMID 23803709 .
- ↑ H. de Lavallade, JF Apperley, JS Khorashad, D. Milojkovic, AG Reid, M. Bua, R. Szydlo, E. Olavarria, J. Kaeda, JM Goldman, D. Marin: Imatinibe para pacientes recém-diagnosticados com mieloide crônica leucemia: incidência de respostas sustentadas em uma análise de intenção de tratar. In: J Clin Oncol. 10 de julho de 2008; 26 (20), pp. 3358-3363. PMID 18519952
- ↑ M. Talpaz et al.: Dasatinib em leucemias positivas para o cromossomo da Filadélfia resistentes a imatinibe. In: N Engl J Med. 2006; 354, pp. 2531-2541. PMID 16775234
- ↑ H. Kantarjian et al.: Nilotinib em CML resistente a Imatinib e LLA positiva para cromossoma de Filadélfia. In: N Engl J Med. 2006; 354, pp. 2542-2551. PMID 17715389
- ↑ a b A. Hochhaus, T. Ernst, J, Ziermann, E. Eigendorff, P. La Rose: Chronic myeloid leukemia. In: Oncologista. 2012; 18, pp. 1108-1114. Editora Springer
- ↑ Ponatinibe: um inibidor pan-BCR-ABL. ARIAD, acessado em 13 de agosto de 2011 .
- ↑ T. O'Hare, CA Eide, MW Deininger: mutações no domínio da quinase Bcr-Abl, resistência aos medicamentos e o caminho para a cura da leucemia mieloide crônica. In: Blood. 1 de outubro de 2007; 110 (7), pp. 2242-2249. PMID 17496200
- ↑ S. Branford, JV Melo, TP Hughes: Selecionando a terapia com inibidor de tirosina quinase de segunda linha ideal para pacientes com leucemia mieloide crônica após falha de imatinibe: o status da mutação BCR-ABL realmente importa? In: Blood. 24 de dezembro de 2009; 114 (27), pp. 5426-5435. PMID 19880502
- ↑ T. O'Hare, CA Eide, MWN Deininger: mutações no domínio da quinase Bcr-Abl, resistência aos medicamentos e o caminho para a cura da leucemia mieloide crônica. In: Blood. 2007; 110 (7), pp. 2242-2249. PMID 17496200
- ^ S. Redaelli, R. Piazza, R. Rostagno e outros: Atividade de bosutinibe, dasatinibe e nilotinibe contra 18 mutantes BCR / ABL resistentes ao imatinibe. In: J Clin Oncol. 2009; 27 (3), pp. 469-471. PMID 19075254
- ↑ S. Soverini, A. Hochhaus, FE Nicolini, F. Gruber, T. Lange, G. Saglio, F. Pane, MC Müller, T. Ernst, G. Rosti, K. Porkka, M. Baccarani, NC Cross, G. Martinelli: análise de mutação no domínio da quinase BCR-ABL em pacientes com leucemia mieloide crônica tratados com inibidores da tirosina quinase: recomendações de um painel de especialistas em nome da European LeukemiaNet. In: Blood. 2011; 118 (5), pp. 1208-1215. doi: 10.1182 / blood-2010-12-326405 . PMID 21562040 .
- ↑ a b c d Glivec 400 mg comprimidos revestidos por película. Recuperado em 24 de novembro de 2020 .
- ↑ a b “Primum non nocere” e a busca do lucro da indústria farmacêutica - uma contradição insolúvel em oncologia? In: Der Arzneimittelbrief Volume 46, No. 5, maio de 2013.
- ↑ a b Especialistas em leucemia mielóide crônica: O preço dos medicamentos para leucemia mielóide crônica (LMC) é um reflexo dos preços insustentáveis dos medicamentos contra o câncer: da perspectiva de um grande grupo de especialistas em LMC. In: Blood. 2013; 121 (22), pp. 4439-4442. PMID 23620577
- ↑ Caso de patente do Glivec na Índia. Retirado em 3 de abril de 2014 (em inglês, apresentação do caso sob o ponto de vista da Novartis).
- ↑ Nº DO RECURSO CIVIL 2706-2716 DE 2013. (Não está mais disponível online.) Supremo Tribunal da Índia, 1º de abril de 2013, arquivado do original em 7 de abril de 2014 ; acessado em 3 de abril de 2014 .
- ↑ A. Burchert, MC Müller, P. Kostrewa, P. Erben, T. Bostel, S. Liebler, R. Hehlmann, A. Neubauer, A. Hochhaus: Resposta molecular sustentada com manutenção de interferon alfa após terapia de indução com imatinibe mais interferon alfa em pacientes com leucemia mieloide crônica. In: J Clin Oncol. 2010; 28 (8), pp. 1429-1435. PMID 20142590 .

