Clorofilas

A clorofila (do grego antigo χλωρός Chloros "verde claro, fresco" e φύλλον phyllon "folha") ou verde da folha refere-se a uma classe de corantes naturais , que são formados por organismos que operam a fotossíntese . As plantas, em particular, obtêm sua cor verde da clorofila.
Plantas, algas e cianobactérias possuem diferentes tipos de clorofila, as bactérias que impulsionam a fotossíntese possuem diferentes tipos de bacterioclorofila .
Estrutura e propriedades
As clorofilas são estruturas moleculares chamadas de complexos de quelato , consistindo em um anel porfirínico derivatizado e Mg 2+ como íon central. Em contraste com a porfirina, a estrutura básica das clorofilas contém um quinto anel adicional no anel III (numerado de acordo com Fischer). Dependendo do tipo de clorofila, diferentes cadeias laterais são anexadas ao corpo base. Por exemplo, a clorofila a é esterificada com fitol (ver tabela). As clorofilidas são clorofilas sem cadeias laterais.
Estruturalmente, as clorofilas estão relacionadas ao heme , que ocorre como componente do pigmento sanguíneo ( hemoglobina ), mioglobina e citocromos , mas como íon central não contém magnésio, mas ferro . As clorofilas são facilmente solúveis em etanol e acetona, bem como em solventes semelhantes. Se a fotossíntese ocorre em organismos que liberam oxigênio ( fototróficos oxigenados ), geralmente se fala em clorofila . No entanto, os fototróficos anoxigênicos não produzem oxigênio como produto da reação durante a fotossíntese, nesses organismos a clorofila é chamada de bacterioclorofila .
Hans Fischer determinou a estrutura molecular da clorofila em 1940, a configuração absoluta foi elucidada por Ian Fleming em 1967 .
Estrutura química dos fototróficos oxigenados
| Sobrenome | estrutura | C 2 restante | C 3 restante | Resto C 7 | C 8 resto | C 17 restante | Ligação C 17-18 | Fórmula molecular |
|---|---|---|---|---|---|---|---|---|
| Clorofila a |

|
-CH 3 | -CH = CH 2 | -CH 3 | -CH 2 CH 3 | -CH 2 CH 2 COO- fitil | Vínculo simples | C 55 H 72 O 5 N 4 Mg |
| Clorofila b | -CH 3 | -CH = CH 2 | –CHO | -CH 2 CH 3 | -CH 2 CH 2 COO-Fitil | Vínculo simples | C 55 H 70 O 6 N 4 Mg | |
| Clorofila c 1 | -CH 3 | -CH = CH 2 | -CH 3 | -CH 2 CH 3 | -CH = CHCOOH | Ligação dupla | C 35 H 30 O 5 N 4 Mg | |
| Clorofila c 2 | -CH 3 | -CH = CH 2 | -CH 3 | -CH = CH 2 | -CH = CHCOOH | Ligação dupla | C 35 H 28 O 5 N 4 Mg | |
| Clorofila d | -CH 3 | –CHO | -CH 3 | -CH 2 CH 3 | -CH 2 CH 2 COO-Fitil | Vínculo simples | C 54 H 70 O 6 N 4 Mg | |
| Clorofila f | –CHO | -CH = CH 2 | -CH 3 | -CH 2 CH 3 | -CH 2 CH 2 COO-Fitil | Vínculo simples | C 55 H 70 O 6 N 4 Mg |
Estrutura química dos fototróficos anoxigênicos: bacterioclorofilas (Bchl)
a : Nenhuma ligação dupla entre C7 e C8 (marcado em cores na imagem)
b : Bchl c , d e e são uma mistura de isômeros em que o radical R 3 ou R 4 é substituído de forma diferente.
Propriedades espectrais
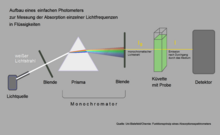
Um espectrômetro de absorção simples pode ser usado para medir qual luz é particularmente fortemente absorvida pela clorofila. Neste exemplo, a abertura é colocada de forma que a luz amarela incida na cubeta com a solução de clorofila. A quantidade de luz amarela emergindo do outro lado da cubeta dificilmente cai abaixo da quantidade de luz incidente, porque quase nada foi absorvido pela clorofila na faixa desses comprimentos de onda. Se você mover o diafragma de forma que a luz vermelha ou azul penetre, o detector atrás da cubeta mede emissões significativamente mais baixas.
O espectro de absorção de em solventes clorofilas dissolvidos sempre possuem dois máximos de absorção distinta de entre 600 e 800 nm, como o Q y - banda é referido, e um, a 400 nm, a banda Soret é chamado. A figura à direita mostra esses máximos de absorção para clorofila a e b . Além disso, existe a banda Q x em torno de 580 nm, que é polarizada perpendicularmente a Q y e geralmente absorve muito fracamente. Para a clorofila a, ela ainda pode ser vista na figura, para a clorofila b ela desaparece no subsolo. A área entre as faixas é chamada de lacuna verde .
Os espectros na figura se torna mais fácil entender por que as folhas - que contêm clorofila a e b - são verdes. Juntos, clorofila um e b absorver principalmente na gama espectral azul (400-500 nm) e na gama espectral vermelha (600-700 nm). Já na área verde, não há absorção, então a luz verde se espalha, o que faz com que as folhas pareçam verdes.

A absorção depende do solvente e, consequentemente, a posição dos máximos de absorção pode variar alguns nanômetros dependendo do tipo de solvente. No ambiente natural das clorofilas, ou seja, o ambiente das proteínas, as coisas são diferentes. Aqui, a posição dos máximos de absorção depende de dois fatores: (1) Dependendo da carga parcial dos aminoácidos circundantes e da curvatura dos grupos laterais das moléculas de clorofila, os máximos de absorção podem estar em comprimentos de onda muito diferentes. (2) Nas proteínas, as clorofilas ficam muito próximas umas das outras, de modo que interagem entre si ( interação dipolo-dipolo ; em distâncias muito curtas também interação de troca ). Essa interação leva a uma redução do nível de energia e, portanto, a um desvio para o vermelho dos máximos de absorção. Isso pode ser visto de forma particularmente impressionante no exemplo do complexo de antena LH2 de bactérias roxas. O complexo LH2 consiste em dois grupos de moléculas de bacterioclorofila dispostas em um anel (veja a figura à esquerda). O anel superior (B850) contém 18 moléculas de BChl a , que estão muito próximas umas das outras, isto é, estão fortemente acopladas. O anel inferior (B800) consiste em 9 moléculas BChl a , que estão significativamente mais distantes e, portanto, são muito mais fracamente acopladas.
O forte acoplamento muda a absorção de BChl a no anel B850 para vermelho. A banda de absorção está a 850 nm. O BChl a fracamente acoplado do anel B800, por outro lado, absorve a 800 nm, i.e. aproximadamente na mesma gama que as moléculas de BChl a dissolvidas no solvente . No espectro de absorção (figura à direita) do complexo LH2, as bandas de absorção das moléculas B800 e B850-BChl- a estão claramente separadas. Além disso, bandas que se originam de moléculas de carotenóides são mostradas, mas não na estrutura.
Tipos
Existem vários tipos de clorofila que diferem nos grupos laterais da porfirina. Eles têm diferentes espectros de absorção e ocorrem em diferentes organismos fototróficos:
| Tipo de clorofila | cor | Máximos de absorção (em nm) |
Ocorrência |
|---|---|---|---|
| Clorofila a | azul verde | 430, 662 (em acetona) | Cianobactérias e todos os eucariotos fototróficos |
| Clorofila b | amarelo verde | 454, 643 (em éter dietílico) | Algas verdes ( Chlorophyta ), Euglenozoa e todas as plantas terrestres |
| Clorofila c | verde | 444, 576, 626 | em vez de clorofila b nas algas marrons ( Phaeophyta ), diatomáceas ( Bacillariophyta ), algas douradas ( Chrysophyta ), algas verde-amarelas ( Xanthophyta ), Haptophyta , Dinophyta e Raphidophyceae |
| Clorofila d | 447, 688 | em vez de clorofila b nas algas vermelhas ( Rhodophyta ) | |
| Bacterioclorofila a | verde | 358, 577, 773 (em acetona) | Bactéria roxa ( Rhodospirillaceae , Chromatiaceae ) |
| Bacterioclorofila b | 368, 580, 794 (em acetona) | Bactéria roxa de enxofre ( Chromatiaceae ); Bactéria roxa | |
| Bacterioclorofila c | verde | 432, 660 (em acetona?) | Bactéria sulfurosa verde ( Chlorobiaceae ) |
| Bacterioclorofila c p | 740 ( in vivo ) | Bactéria verde sem enxofre ( Chloroflexaceae ) | |
| Bacterioclorofila d | 458, 646 (em quê?) 427, 654 (em acetona) | Bactéria sulfurosa verde ( Chlorobiaceae ) | |
| Bacterioclorofila e | 424, 654 (em quê?) 462, 649 (em acetona) | Bactéria sulfurosa verde ( Chlorobiaceae ) | |
| Bacterioclorofila g | 408, 418, 470, 575, 763 (em quê?) 412, 788 ( in vivo ) | Heliobactéria |
biossíntese
A clorofila está em eucariotos nos cloroplastos sintetizados em procariotos no citoplasma . No caso de muitos fototróficos , a formação de clorofila é induzida pela luz e não ocorre sem exposição. A biossíntese consiste em uma série de numerosas etapas com um número correspondente de enzimas específicas .
A síntese deste e de outros tetrapirróis é um processo de várias etapas que também possui vários pontos de ramificação. A biossíntese começa a partir do L - glutamato e termina em um siroheme -, um heme - e um ramo da clorofila.
Após várias etapas, o uroporfirinogênio III é formado a partir do L- glutamato , o primeiro ponto de ramificação a partir do qual o siroheme pode ser formado. O uroporfirinogênio III é então convertido em protoporfirina IX em três etapas , que é o segundo ponto de ramificação do heme. Na protoporfirina IX, o íon magnésio é introduzido em uma reação dependente de ATP, que catalisa uma quelatase de magnésio ( EC 6.6.1.1 ). A protoporfirina IX de Mg formada desta forma é convertida em protoclorofilida a de vinila por meio do éster monoetílico da protoporfirina IX de Mg . Essa etapa é catalisada por uma ciclase que introduz o quinto anel na clorofila. Em plantas, essa enzima é dependente de O 2 , enquanto em procariotos existem ciclases dependentes de O 2 e independentes.
Na próxima etapa, o anel D do protocloropilo é reduzido a divinil clorofilida a por uma oxidorredutase ( EC 1.3.1.33 ) . Nas angiospermas, essa reação é absolutamente dependente da luz. Portanto, as mudas não formam clorofila até que sejam expostas à luz. Outras plantas (algumas gimnospermas ), algas, mas também cianobactérias, possuem uma oxidorredutase dependente e independente da luz. Como resultado, esses organismos podem sintetizar clorofila mesmo no escuro. A divinil clorofilida a é reduzida a monovinil clorofilida a por uma redutase antes de ser esterificada em clorofila a em uma etapa final usando fitol fosfato . Esta etapa terminal é catalisada por uma clorofila sintetase, uma prenil transferase ( EC 2.5.1.62 ).
A clorofila b também pode ser formada a partir da clorofila a ou vice-versa.
A quebra da clorofila em árvores decíduas produz uma cor característica das folhas no outono. A clorofila é metabolizada em clorofilida pela clorofilase . Isto é seguido por uma troca iônica pelo Mg 2+ - Dechelatase para feoforbídeo . O feoforbeto é oxidado pelo feoforbeto A oxigenase com o cofator ferredoxina , por meio do qual a cor verde desaparece e, primeiro, vários produtos de degradação fluorescentes (FCC, do inglês fluorescente clorofila catabólitos ) e, na degradação posterior, surgem substâncias não fluorescentes (NCC). Em Maple, a clorofila é outra via para o desmantelamento do Dioxobilan .
Importância na fotossíntese
As clorofilas têm várias funções na fotossíntese no fotossistema I e no fotossistema II . De longe, a maior parte é usada para absorção de luz e transmissão da energia absorvida. Portanto, eles atuam como fotossensibilizadores . Para isso, as moléculas de clorofila são organizadas em complexos coletores de luz , os quais são dispostos de tal forma que por um lado se forma a maior superfície absorvente possível e por outro lado é criado um funil energético que orienta a energia absorvida para o chamado centro de reação . No centro de reação, duas clorofilas atuam como aceitadores dessa energia. Eles são arranjados de forma tão especial que sua excitação leva a uma separação de carga, que pode ser considerada o primeiro passo na fotossíntese real. Este par de clorofila é chamado de par especial em inglês .
Existem muitas diferenças na estrutura dos complexos de coleta de luz nos diferentes organismos que conduzem a fotossíntese, mas o centro de reação é quase sempre estruturado da mesma maneira. Nas plantas, algas e cianobactérias, o par especial é sempre formado pela clorofila a , nas bactérias por várias bacterioclorofilas.
Ocorrência na comida
O conteúdo de clorofila é particularmente alto em vegetais verdes. A clorofila um e b conteúdo de vegetais e de frutas, por 100 g de matéria fresca está listado na tabela a seguir em ordem decrescente de clorofila um conteúdo:
| Clorofila a | Clorofila b | |
|---|---|---|
| Couve | 189 mg | 41 mg |
| Urtiga grande | 185 mg | 173 mg |
| salsa | 157 mg | 55 mg |
| espinafre | 95 mg | 20 mg |
| Brócolis | 26 mg | 6 mg |
| Vagem | 12 mg | 4 mg |
| ervilhas verdes | 10 mg | 2 mg |
| pepino | 6 mg | 2 mg |
| Fruta kiwi | 1,7 mg | 0,4 mg |
| repolho branco | 0,3-1 mg | 0,1-0,2 mg |
Com o rótulo E 140 , as clorofilas ( CI Natural Green 3 ) são aprovadas como corantes alimentares .
Cada vez mais estudos mostram que as substâncias vegetais secundárias têm um efeito positivo nos processos metabólicos humanos. Isso se aplica à clorofila, bem como aos flavonóides e carotenóides , por exemplo .
história
As primeiras descrições de um “ corante ” que pode ser extraído por etanol (“aguardente vínica”) e decomposto sob a influência da luz podem ser encontradas no livro de Heinrich Friedrich Link “Basic Teachings of Anatomy and Physiology of Plants”, Göttingen 1807. Lá também são ambíguos. Evidência de que Joseph Louis Proust descreveu o corante verde como "Fécule". Pierre Joseph Pelletier e Joseph Bienaimé Caventou extraíram a substância novamente e a chamaram de clorofila . Os primeiros estudos sobre a estrutura química da clorofila vêm de Richard Willstätter (1913). O químico Hans Fischer retomou a pesquisa de Willstätter na década de 1930 e, em 1940, conseguiu elucidar a estrutura da molécula. A pesquisa de Fischer foi confirmada em 1960 pela síntese de clorofila de Robert B. Woodward . Mesmo antes de Woodward, a síntese total foi bem-sucedida de uma maneira um tanto diferente por um grupo de químicos do antigo local de trabalho de Fischer, a Universidade Técnica de Munique. Alfred Treibs e Martin Strell , ex-funcionários de Fischer, continuaram seu trabalho na síntese total da clorofila. O objetivo de ambos os grupos era a síntese do feoforbídeo a , uma vez que Willstätter já havia descrito a síntese residual com base nisso.
Diversos
Uma propriedade importante da clorofila é a fluorescência da clorofila . É usado principalmente para determinar o conteúdo de clorofila e sua atividade, bem como para outras análises científicas.
Devido ao seu efeito neutralizador de odores, a clorofila também está disponível em forma de comprimido nas farmácias como um remédio para o mau hálito e o odor corporal.
Veja também
literatura
- Hans W. Heldt e Birgit Piechulla: Plant biohemistry . 4ª edição. Spectrum Academic Publishing House, 2008, ISBN 978-3-8274-1961-3 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry . 6ª edição. Spectrum Academic Publishing House, Heidelberg 2007, ISBN 978-3-8274-1800-5 .
- R. Tanaka, A. Tanaka: Tetrapyrrole biosynthesis in upper plants . In: Annu Rev Plant Biol . 58; 321-346; PMID 17227226 . 2007; doi: 10.1146 / annurev.arplant.57.032905.105448
Links da web
- Via metabólica para a formação de clorofila e heme nas enzimas KEGG
- Espectros de absorção da Oregon University of Health & Sciences
Evidência individual
- ^ Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus e Uwe Sonnewald: Strasburger - Textbook of Botany . 36ª edição. Spektrum Akademischer Verlag, Heidelberg 2008, página 315, ISBN 978-3-8274-1455-7 ; P. 277.
- ^ Ian Fleming : Absolute Configuration and the Structure of Chlorophyll , Nature 1967, 216 , 151-152 doi: 10.1038 / 216151a0 .
- ↑ Hiper Física: Cores Espectrais
- ^ Hugo Scheer (editor): Clorofilas. CRC Press, 1991. ISBN 0-8493-6842-1 .
- ↑ a b c d Gerhard G. Habermehl , Peter E. Hammann, Hans C. Krebs, W. Ternes: Naturstoffchemie. Uma introdução . 3. Edição. Springer, Berlin 2008, ISBN 978-3-540-73732-2 , pp. 530 .
- ↑ a b c d e f g h Michael T. Madigan, John M. Martinko: Brock - microbiologia . 11ª edição. Pearson Studium, Munich / Boston et al., 2009, ISBN 978-3-8273-7358-8 , p. 607 (inglês: Brock biology of microrganisms . Traduzido por Thomas Lazar, Freya Thomm-Reitz).
- ↑ Samuel I. Beale: Enzymes of chlorophyll biosynthesis (artigo de revisão). In: Photosynthesis Research . Vol. 60, 1999. pp. 43-73. O caminho de biossíntese também é mostrado aqui.
- ↑ Hans W. Heldt e Birgit Piechulla: Plant bioquímica . 4ª edição. Spektrum Akademischer Verlag, 2008, ISBN 978-3-8274-1961-3 , página 292.
- ^ A b T. Müller, M. Rafelsberger, C. Vergeiner, B. Kräutler: Um dioxobilane como produto de um trajeto divergente da divisão da clorofila no bordo da Noruega. In: Angewandte Chemie. Volume 50, número 45, novembro de 2011, pp. 10724-10727, doi : 10.1002 / anie.201103934 , PMID 21928453 , PMC 3262146 (texto completo gratuito).
- ↑ a b c P. Matile, S. Hortensteiner, H. Thomas, B. Krautler: Chlorophyll Breakdown in Senescent Leaves. In: Fisiologia vegetal. Volume 112, Número 4, dezembro de 1996, pp. 1403-1409, PMID 12226455 , PMC 158071 (texto completo livre).
- ↑ Entrada em E 140: Clorofilas e clorofilinas no banco de dados europeu para aditivos alimentares, acessado em 16 de junho de 2020.
- ↑ Especificações dos aditivos alimentares permitidos
- ↑ Fitoquímicos e seus efeitos na saúde - uma atualização com base no Relatório de Nutrição de 2012. Acessado em 15 de abril de 2021 .
- ↑ Pelletier & Caventou, Sur la Matiere verte des Feuilles Annales de Chimie et de Physique , 1818, 9, 194–196 ( visualização limitada na pesquisa de livros do Google).
- ↑ M. Strell, A. Kalojanoff, H. Koller, síntese parcial da estrutura básica da clorofila a, do feoforbeto a , Angew. Chem .. 72, 169-170 (1960).
- ↑ Eric Fontain, The Munich Chlorophyll Synthesis , TU Munich, 2000