Açúcar sanguíneo

O nível de açúcar no sangue é geralmente entendido como a quantidade de glicose no sangue . A glicose é uma importante fonte de energia para o corpo. O cérebro , os glóbulos vermelhos e a medula renal são dependentes da glicose para a produção de energia; todas as outras células do corpo obtêm a energia principalmente no metabolismo da gordura . A glicose é capaz de cruzar a barreira hematoencefálica e, assim, abastecer o cérebro.
Na medicina, o nível de açúcar no sangue ( nível de açúcar no sangue , nível de glicose ) é um importante valor medido. Se estiver permanentemente aumentado, pode estar presente diabetes mellitus .
Uma baixa de açúcar no sangue pode reduzir a função cerebral que causa convulsões, aumento da adrenalina e mãos trêmulas e suores. Na forma pronunciada, a hipoglicemia leva ao choque . É tipicamente encontrado no insulinoma muito raro , mas em alguns casos também como um sintoma inicial de diabetes tipo 2, raramente mesmo sem outras doenças após uma refeição com carboidratos de absorção rápida . É uma complicação comum de alguns medicamentos no tratamento do diabetes mellitus.
Teste de glicose no sangue
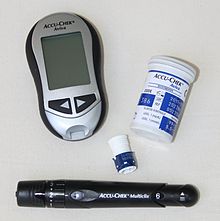
O açúcar no sangue é medido a partir de uma amostra de sangue , geralmente do sangue capilar . Do ponto de vista da precisão da medição, uma distinção deve ser feita entre as medições feitas pelo próprio paciente usando medidores de glicose no sangue e medições de alta qualidade no laboratório.
Como uma unidade na maioria dos países, o compatível com SI (será o Sistema Internacional de Unidades ) Unidade mmol / L ( milimoles por litro). Na parte ocidental da Alemanha (e Berlim), como nos EUA, Polônia, França, Itália, Japão ou Áustria, a unidade mais antiga (mas também compatível com SI) mg / dl (miligramas por decilitro, sinônimo disso não é) Unidade compatível com SI ( mg% ) é usada.
O nível de açúcar no sangue pode ser determinado de forma muito rápida e confiável com dispositivos de medição de açúcar no sangue que estão disponíveis opcionalmente com unidades de medida programadas pelo fabricante em mmol / l ou mg / dl. Vários princípios ativos estão em uso, consulte a seção Princípios ativos. Sistemas de medição de açúcar no sangue podem ser prescritos se uma indicação for estabelecida e são reembolsados por seguradoras de saúde.
Por um tempo, dispositivos de medição estavam disponíveis que podiam exibir o resultado em mg / dl ou em mmol / l. De acordo com o Instituto Federal de Drogas e Dispositivos Médicos , isso levou a confusões da unidade de medida subjacente em vários casos, o que resultou na dosagem errada de insulina . Por esse motivo, os dispositivos conversíveis foram retirados do mercado desde o quarto trimestre de 2006. Houve um problema semelhante na Suíça .
Conversão de mmol / l ↔ md / dl:
Valores normais
Em humanos, os valores normais são:
- jejum: 70-99 mg / dl, correspondendo a 3,9-5,5 mmol / l
- após uma refeição rica em carboidratos:
- máximo até 160 mg / dl, correspondendo a 8,9 mmol / l
- abaixo de 140 mg / dl após 2 horas, correspondendo a 7,8 mmol / l
No entanto, os valores diferem dependendo da fonte da literatura e do material de teste (plasma venoso, sangue total venoso ou sangue total capilar - ver tabelas). Valores de açúcar no sangue em jejum (NBZ)> 5,5 mmol / l ou> 99 mg / dl (de acordo com outras fontes> 6,1 mmol / l ou 110 mg / dl) indicam tolerância à glicose diminuída, valores de jejum> 125 mg / dl dl ou> 6,9 mmol / l para diabetes mellitus . Como complicação, valores significativamente aumentados no contexto do tratamento de feridas levam à cicatrização prolongada ou prejudicada. Se necessário, quando o diabetes mellitus é diagnosticado, a insulina deve ser usada para auxiliar na cicatrização de feridas .
| classificação | Açúcar no sangue em jejum (NBZ, venoso) |
Açúcar no sangue 2 horas após comer (ou oGTT ) (venoso) |
|---|---|---|
| normal | <110 mg / dl <6,1 mmol / l |
<140 mg / dl <7,8 mmol / l |
Glicose de jejum anormal (IFG) |
110-125 mg / dl 6,1-6,9 mmol / l |
<140 mg / dl <7,8 mmol / l |
Tolerância à glicose prejudicada (IGT) |
<126 mg / dl <7,0 mmol / l |
140-200 mg / dl, 7,8-11,1 mmol / l |
| Diabetes mellitus | ≥ 126 mg / dl ≥ 7,0 mmol / l |
≥ 200 mg / dl ≥ 11,1 mmol / l |
Abreviações na tabela acima
- IFG = glicose de jejum prejudicada (literalmente: glicose de jejum alterada)
- IGT = tolerância à glicose diminuída (literalmente: tolerância à glicose diminuída)
| Controle de açúcar no sangue | Metabolismo saudável |
|---|---|
| Açúcar no sangue sóbrio | 65-100 mg / dl 3,6-5,6 mmol / l |
| Açúcar no sangue depois de comer |
80-126 mg / dl 4,5-7,0 mmol / l |
| Açúcar no sangue à noite | 65-100 mg / dl 3,6-5,6 mmol / l |
|
Valor de HbA 1c ( valor padronizado de acordo com os ensaios DCC) |
<6,05 |
| Medição | Valores normais | Suspeito / pré-diabetes |
Diabetes mellitus |
|
|---|---|---|---|---|
| sóbrio | <100 mg / dl <5,6 mmol / l |
100-126 mg / dl 5,6-7,0 mmol / l |
> 126 mg / dl > 7,0 mmol / l |
|
| 2 horas após comer ou no oGTT |
capilar | <140 mg / dl <7,8 mmol / l |
140-200 mg / dl, 7,8-11,1 mmol / l |
> 200 mg / dl > 11,1 mmol / l |
| venoso | <120 mg / dl <7,0 mmol / l |
120-180 mg / dl 7,0-10,0 mmol / l |
> 180 mg / dl > 10,0 mmol / l |
|
| HbA 1c | <6,5% | 6,5-7,5% | > 7,5% | |
Um nível de açúcar no sangue muito alto é chamado de hiperglicemia e hipoglicemia muito baixa . Uma forma especial de hemoglobina , a HbA1c , é capaz de reproduzir o curso de açúcar no sangue por um período máximo de três meses e, portanto, também é chamada de "memória de açúcar no sangue". A hemoglobina é o pigmento vermelho do sangue nos eritrócitos que transporta oxigênio. A HbA1c é a hemoglobina que não foi glicada enzimaticamente devido a uma concentração excessivamente alta de açúcar no sangue . O HbA1c fornece informações sobre os últimos três meses, uma vez que a vida útil dos eritrócitos é de 120 dias.
Métodos de medição
Existem essencialmente três métodos de medição que foram estabelecidos para medidores de automonitoramento de glicose no sangue .
Medição ótica
Com a medição óptica , o sangue na tira de teste é aspirado por meio de um capilar para um campo de teste visível externamente. Várias substâncias químicas são armazenadas lá, que reagem com o sangue e mudam a cor do campo de teste. Esta mudança de cor é registrada pelo dispositivo de medição e determinada pela duração e intensidade da mudança no valor de açúcar no sangue.
Medição amperométrica
Com a medição amperométrica , o sangue na tira de teste é sugado para um campo de teste por meio de um capilar . No campo de teste, o sangue está em contato com a glicose oxidase e vários eletrodos . O dispositivo de medição aplica uma tensão elétrica definida (aprox. 300–600 mV) a esses eletrodos e mede a corrente que flui sobre os eletrodos ao longo do tempo . O dispositivo determina o valor de açúcar no sangue a partir da corrente medida. A corrente é proporcional à concentração de glicose do líquido na contenção (área do sensor do capilar). Este também é o método dominante em aplicações comerciais ao usar um sensor de glicose de medição contínua .
Medição não invasiva
No caso de métodos sem lesões, chamados de métodos não invasivos, o nível de açúcar no sangue pode ser exibido, monitorado ou registrado ao longo do tempo, sem a necessidade de coleta de sangue. Com esses e outros métodos de medição semelhantes, o registro ou exibição permanente do curso do tempo (monitoramento) do nível de açúcar no sangue é basicamente possível.
- Com um laser de banda larga na faixa do infravermelho médio (MIR), o valor de açúcar no sangue pode ser determinado através da pele sem lesões usando "densitometria de comprimento de onda múltiplo".
- Uma análise óptica espectral do fundo do olho, que é muito bem suprido de sangue, pode fornecer valores muito precisos. Um microssensor passivo implantado no olho também pode aumentar a qualidade das medições.
- Com um microespectrômetro implantado permanentemente sem componentes móveis, a medição espectroscópica de açúcar no sangue na faixa do infravermelho próximo (NIR) pode ser realizada ( espectroscopia de IV ). Este sensor transmite seus valores medidos para um dispositivo de exibição com um transponder passivo .
Esses e outros métodos não invasivos ainda estão sendo pesquisados ou estão em aprovação clínica (principalmente nos EUA). Um nanossensor sensível à glicose foi recentemente desenvolvido na American Northeastern University em Boston, cujas nanopartículas são injetadas como uma tatuagem e ficam fluorescentes quando os níveis de açúcar no sangue estão altos. Um método está sendo desenvolvido na Brown University que usa interferometria de plasmon para medir o conteúdo de glicose da saliva .
Um lançamento no mercado da medição não invasiva da glicose no sangue usando métodos de medição espectroscópica na faixa do infravermelho próximo (NIR) com dispositivos de medição extracorpórea falhou até agora porque os dispositivos podem detectar o açúcar do tecido, i. H. Determine a glicose por volume de tecido corporal irradiado e não o açúcar no sangue por volume de sangue porque o feixe de medição deve penetrar no tecido corporal para a medição.
Determinação de glicose na urina
Também é possível medir o valor da glicose urinária. No entanto, a glicose só pode ser detectada na urina se a concentração de glicose aumentar muito e ultrapassar um determinado valor. Este valor depende do denominado limiar renal da respectiva pessoa a testar . No entanto, esse limite renal não é confiável e pode ser facilmente destruído. Durante a gravidez , por exemplo, o limiar renal pode cair para abaixo de 120 mg / dl (6,7 mmol / l), em pessoas saudáveis também pode ser acima de 200 mg / dl (11,1 mmol / l). Mesmo uma doença renal leve pode alterar o limiar renal. Devido à confiabilidade relativamente alta e boa disponibilidade dos dispositivos de medição de açúcar no sangue com os mesmos preços elevados para as fitas de medição, a determinação do açúcar na urina pode ser considerada desatualizada.
regulamento
O nível de açúcar no sangue é regulada pela interacção de duas hormonas peptídicas no pâncreas . Esta glândula contém sistemas sensores de açúcar no sangue em suas células α e β , que respondem da seguinte forma:
- quando o nível de açúcar no sangue cai ("sinal de fome"), o glucagon é secretado . Este hormônio ativa a glicogênio fosforilase (PYG) no fígado , que inicia a quebra do glicogênio em glicose ( ramo catabólico ) (imagem superior)
- Quando o nível de açúcar no sangue aumenta, a insulina é secretada, o que inicia uma série de reações de consumo de glicose, especialmente no fígado ( ramo anabólico ). De importância central aqui é a ativação indireta da glicogênio sintase (GYS), que usa o excesso de glicose para construir o glicogênio de armazenamento de energia ("amido animal") (imagem inferior)
Além disso, a adrenalina ativa a glicogênio fosforilase nas células do músculo esquelético. Os níveis elevados de monofosfato de adenosina no fígado e nos músculos também ativam a enzima, assim como a liberação de cálcio do retículo sarcoplasmático com subsequente ligação à calmodulina .
A quebra e o acúmulo de glicogênio são estritamente contra-regulados pela fosforilação das principais enzimas glicogênio fosforilase (PYG) e glicogênio sintase (GYS), portanto, eles nunca funcionam simultaneamente. Em situações de deficiência energética, ambas as enzimas são fosforiladas por quinases; este processo estimula a fosforilase, mas inibe a sintase. Se houver excesso de glicose, a situação é revertida pela ação das fosfatases : A perda dos resíduos de fosfato inativa o PYG, mas ativa o GYS.
Tanto o glucagon quanto o sinal da insulina são amplificados por meio de cascatas de sinal. As proteínas quinases estão no centro de ambas as vias de sinal: cada quinase fosforila várias moléculas de uma quinase a jusante.
- No caso do glucagon ou adrenalina, um receptor dependente da proteína G ( GPCR , tipo de hélice sete transmembrana) é ativado. A adenilato ciclase , uma enzima que produz o segundo mensageiro cAMP , é ativada por meio da proteína G s . Isso inicia a cascata da proteína quinase A (PKA), no final da qual está a glicogênio fosforilase (PYG). Após a fosforilação é ativado (PYG a ). Isso libera glicose-1-fosfato do glicogênio, que é isomerizado em glicose-6-fosfato e pode entrar na glicólise . Ao mesmo tempo, a PKA também fosforila a glicogênio sintase (GYS a ), que é inativa em sua forma fosforilada (GYS b ).
- No caso da insulina, um receptor tirosina quinase (RTK) é ativado. No caminho de uma transdução de sinal complexa, inter alia a proteína quinase B (PKB) é ativada (veja o painel inferior, A). PKB fosforila a glicogênio sintase quinase 3 , GSK3, que é assim inativada. GSK3 é uma quinase que fosforila a glicogênio sintase e, portanto, a inativa (GYS b ). GSK3 compete com uma fosfatase, proteína fosfatase 1 (PP1). Como o GSK3 não pode mais funcionar, há cada vez mais glicogênio sintase em sua forma desfosforilada (GYS I, veja a imagem abaixo, B). PKB também ativa uma fosfodiesterase, PDE, que hidrolisa cAMP em AMP. Como resultado, o caminho do sinal para o PKA também é extinto.
Veja também
Links da web
Evidência individual
- ↑ Mark E Daly: Efeitos agudos na sensibilidade à insulina e perfis metabólicos diurnos de uma dieta rica em sacarose em comparação com uma dieta rica em amido . (PDF) In: American Society for Clinical Nutrition (Ed.): Am J Clin Nutr 1998 . No. 67, 1998, pp. 1186-1196. Recuperado em 19 de fevereiro de 2011.
- ↑ Diretriz para Controle de Diabetes Pós-prandial (PDF; 920 kB) Federação Internacional de Diabetes . P. 22, 2008. Arquivado do original em 28 de junho de 2011. Recuperado em 30 de julho de 2011.
- ↑ Definição e diagnóstico de diabetes mellitus e hiperglicemia intermediária ( Inglês , PDF; 1,6 MB) In: World Health Organization . who.int. P. 36. 2006. Recuperado em 20 de fevereiro de 2011.
- ↑ a b M.A. Rahim, AK Azad Khan, Q. Nahar, SM Ali, A. Hussain: Diminuição da glicose em jejum e diminuição da tolerância à glicose na população rural de Bangladesh. In: Boletim do Conselho de Pesquisa Médica de Bangladesh , Volume 36, Número 2, agosto de 2010, pp. 47-51, PMID 21473200 , ISSN 0377-9238 .
- ↑ Paul-Martin Holterhus et al.: Diagnóstico, terapia, controle do progresso do diabetes mellitus em crianças e adolescentes (PDF), deutsche-diabetes-gesellschaft.de, 2010, p. 18 (acessado em 20 de fevereiro de 2011).
- ↑ W. Kerner, J. Brückel: Definição, classificação e diagnóstico de diabetes mellitus (PDF; 846 kB) DDG. 1 ° de outubro de 2012. Recuperado em 1 ° de abril de 2013.
- ^ EF Pfeiffer: O sensor de glicose: o elo que faltava na terapia do diabetes. In: Horm Metab. Res. Vol. 24, 1990, pp. 154-164.
- ^ Para lasers do Mid-IR do ganho largo . (PDF; 1,7 MB) Instituto Fraunhofer IAF, 2003.
- ↑ Teste não invasivo de glicose no sangue . ( Memento de 6 de julho de 2007 no Internet Archive ) University of Karlsruhe, Institute for Technology and Information Processing, 2004.
- ↑ Medição e regulação in vivo dos níveis de açúcar no sangue . RWTH Aachen, Presidente de Tecnologia da Informação Médica.
- ↑ Clark Lab | Nanosensores. In: nuweb9.neu.edu. Arquivado do original em 27 de julho de 2011 ; Recuperado em 27 de julho de 2011 .
- ^ Vince S. Siu, Jing Feng, Patrick W. Flanigan, G. Tayhas R. Palmore, Domenico Pacifici: A “cubeta plasmônica”: química de corante acoplada a interferometria plasmônica para detecção de glicose . In: Nanophotonics . fita 3 , não. 3 , 6 de maio de 2014, p. 125-140 , doi : 10.1515 / nanoph-2013-0057 .
- ^ J Feng, VS Siu, A Roelke, V Mehta, SY Rhieu, GT Palmore, D Pacifici: interferômetros plasmônicos em nanoescala para detecção bioquímica multiespectral de alto rendimento . In: Nano Lett. fita 12 , não. 2 , 8 de fevereiro de 2012, p. 602-609 , doi : 10.1021 / nl203325s , PMID 22200183 .
- ↑ a b c Gisela Boeck, Ulrike Bommas-Ebert, Timo Brandenburger: Examination Knowledge Physikum . Georg Thieme, Stuttgart 2009, ISBN 978-3-13-152131-6 , página 521.
- ↑ Horace Robert Horton: Bioquímica . Pearson Germany, 2008, ISBN 978-3-8273-7312-0 , página 504.




